对于下列事实的解释错误的是
| A.常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不反应 |
| B.浓硝酸在光照的条件下颜色变黄,说明浓硝酸不稳定 |
| C.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸 |
上图为某化学反应的速率与时间的关系示意图。在t1 时刻改变温度或压强,正逆反应速率的变化都符合示意图的反应是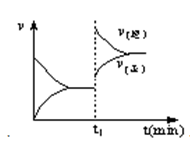
A.2SO2(g)+O2(g)  2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
对室温下100 mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是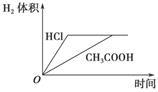
| A.加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 |
| B.温度都升高20 ℃后,两溶液的pH不再相等 |
| C.加水稀释至溶液体积为200 mL后,醋酸的电离度减小,电离平衡常数也减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示 |
一定温度下,两个恒容密闭容器中分别发生反应:
①H2(g)+I2(g) 2HI(g);
2HI(g);
②C(s)+H2O(g) CO(g)+H2(g),
CO(g)+H2(g),
下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;b.容器内气体压强不变;c.容器内气体密度不变;d.容器内气体颜色不变;e.各组分的物质的量分数或质量分数不变;f.混合气体的平均分子量不变;
| A.ae | B.aef | C.abc | D.ac |
已知热化学方程式:aX(g)+3Y(g) bZ(g) △H<0 。现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态:此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为
bZ(g) △H<0 。现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态:此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为
| A.800 | B.5/4 |
| C.35 | D.20 |
在一定温度下,固定容积的容器中加入a mol A和b mol B,发生反应:A(g)+2B(g) 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
A.再充入少量A,平衡向正反应方向移动,但K值不变
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar)增大压强,平衡向正反应方向移动