从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(一)海水淡化的方法主要有 (只填一种)。
(二)从海水中提取溴和镁的流程如下图所示:
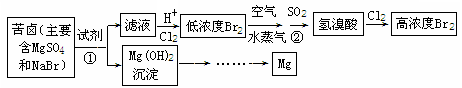
(1)提取Br2时,第一次通入Cl2后发生反应的离子方程式是
②中SO2表现 (填“氧化”或“还原”)性;第二次通入Cl2后,要提取Br2还要进行的操作为 。
(2)为了实现对镁离子的富集,①中加入的足量试剂是 (填化学式);
请从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是 (填字母)。
A.Mg(OH)2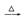 MgO MgO  Mg Mg |
B.Mg(OH)2 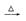 MgO MgO  Mg Mg |
C.Mg(OH)2 无水MgCl2 无水MgCl2 Mg Mg |
D.Mg(OH)2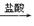 MgCl2(溶液) MgCl2(溶液) Mg Mg |
PbI2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如下:

(1)将铅块制成铅花的目的是 。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸 mL,同时产生 L(标准状况下)NO。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率
随温度的变化如下图所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n= (填数字)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为 (写结构简式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。计算室温时PbI2的Ksp (请给出计算过程)。
丹参酮ⅡA是一种治疗心血管疾病的药物,其中的一种合成路线如下: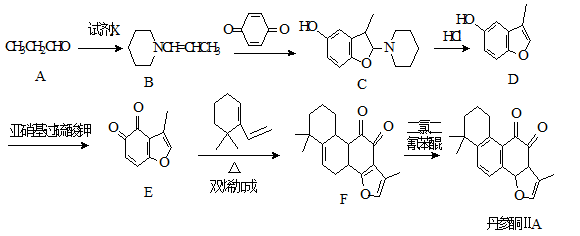
(1)丹参酮ⅡA中含氧官能团为 和 (写名称)。
(2)试剂X的分子式为C5H11N,则X的结构简式为 。
(3)C→D的反应类型为 。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.能发生银镜反应
Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢
(5)写出以CH3CH=CHCH3和CH2=CHCHO为原料制备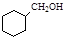 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下: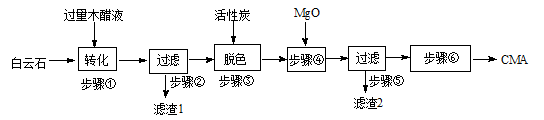
(1)步骤①发生的反应离子方程式为 。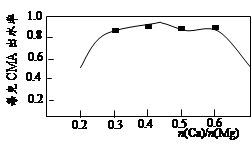
(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填:1∶2;3∶7;2∶3)外,另一目的是 。
(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
向某密闭容器中加入0.30mol A、0.10mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.如图2为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各只改变一种条件,所改变的条件均不同.已知t3~t4阶段为使用催化剂.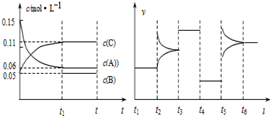
图1图2
(1)若t1=20s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)= ; t4~t5阶段改变的条件为 ;(t0为坐标原点)
(2)若t2~t3阶段,C的体积分数在不断地变小,则此阶段v(正) v(逆) (填“>”、“=”、“<”); t3~t4的平衡常数K= 。
(3)t5~t6阶段改变的条件为 ;B的起始物质的量为 ;
(4)t1达到平衡后,若保持容器温度和体积不变,再向容器中加入0.08mol A,0.2mol C,则平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(5)在温度和容积不变条件下,能判断该反应达到平衡的依据是
A.混合气体的平均相对分子质量不变 B.反应体系的总压强不变
C.生成2mol C的同时生成3mol AD.2v生成(A)=3v生成(C)
(1)0.010 mol/L的HCN(aq)与0.010 mol/L NaCN(aq)等体积混合,已知该混合溶液中c(Na+) > c(CN-),则溶液中c(OH -) c(H +)( 用“>、<、=”符号填空)。
(2)溶质的物质的量浓度相同的 HCl(aq) 、H2SO4(aq) 、CH3COOH(aq)各100 mL,①水的电离程度最大的是 溶液 ②分别与同样的锌粒反应,开始时反应速率最快的是 溶液(写名称)。
(3)某温度下,纯水中的c(H +) = 2.0×10-6mol/L,则此时PH=3的硫酸溶液中,c(OH -) = ,水电离的H+的物质的量浓度是 。