合成治疗脑缺血的药物I的一种路线如下:
已知:
①
②I结构中分别有一个五原子环和一个六原子环。
③F能发生银镜反应。
完成下列填空:
(1)D→E的反应类型为______;F中不含氧的官能团有_________(写名称)。
(2)按系统命名法,A的名称是_______;I的结构简式为__________。
(3)H在一定条件下可以合成高分子树脂,其化学方程式为_____________________。
(4)G的同分异构体有多种,其中含有酚羟基,且结构中有4种不同性质氢的结构有_____种。
(5)化合物D经下列步骤可以得到苯乙烯:
反应Ⅰ的条件为________________;试剂X是_______________;
反应Ⅱ的化学方程式为___________________________________。
原子序数11—17的元素,自钠到氯,电子层数相同,最外层电子数从增加到,随着核电荷数依次递增,原子半径依次,核对外层电子的引力逐渐,失电子能力逐渐,得电子能力逐渐,因此,金属性逐渐,非金属性逐渐。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A , C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
由铜、锌和稀硫酸组成的原电池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从极到极;电流方向是从极到极。
下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈______________
(2) MnO2加入双氧水中反应更剧烈______________
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完___________
(4) 镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生________
根据下列叙述,画出对应1--3的微粒结构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍:。
(2)与Ar原子电子层结构相同的-1价阴离子:。
(3)质量数为23,中子数为12的原子。
(4)写出下列物质的名称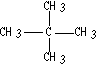 ___________
___________
(5)C5H12的同分异构体有种