铜是一种重要的金属元素,位于元素周期表第ⅠB族,+1价的铜与氯离子结合的生成的CuCl是一种难溶物质,但它可与过量的Cl-形成可溶于水的络离子[CuCl2]-。含铜最丰富的天然资源是黄铜矿(CuFeS2)。
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高。其主要流程如下:
①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2 + FeCl3 = +4 + 2S。
②写出反应Ⅳ中发生反应的离子方程式:
。
③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
。
④已知Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu。则反应Ⅴ所得溶液A中含有的溶质有 。
(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。与上面湿法冶炼技术方法比较,新方法的优点是 、 。
亚硫酸钠中的+4价硫,既有氧化性,又有还原性。现有试剂:溴水、Na2S溶液、 Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
有一混合气体,可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下,取此气体200 mL进行实验,实验的过程和结果如下:
①观察此混合气体为无色。
②将此气体通过浓硫酸,气体体积减少了40 mL。
③将②中剩余的气体,通过Na2O2固体,气体体积变为120 mL。
④将③中剩余的气体引燃充分反应后,冷却至常温,气体体积又减少了105 mL。(上述气体的体积都是相同条件下测定的)。
⑤剩余气体通过加热的铜网,剩余10 mL气体。
根据上述实验,试推断:
(1)混合气体中肯定存在的气体是_________,它们的体积分别为_________。
(2)混合气体中肯定不存在的气体是__________________。
(3)混合气体中可能含有的气体是_________,其体积共为_________。
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案: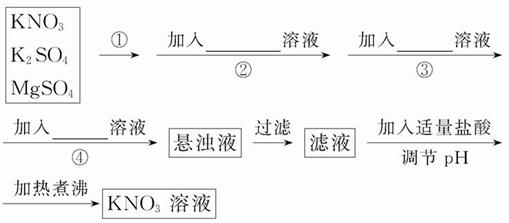
(1)操作①为___________________________。
(2)操作②~④加入的试剂依次可以为:___________________________________________________。
(3)如何判断SO42-已除尽?____________________________。
(4)实验过程中产生的多次沉淀_______ (填“需要”或“不需要”)多次过滤,其理由是_______________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由:___________________________________。
根据如图描述,完成下列问题: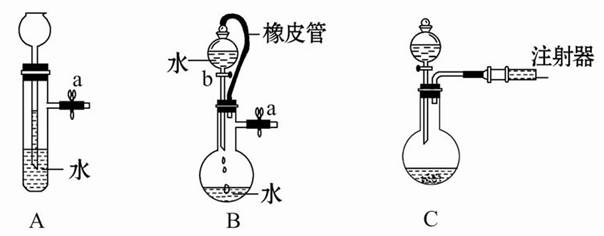
(1)关闭图A装置中的止水夹a,从长颈漏斗向试管中加入一定量的水,静止后如图,判断A装置是否漏气_____(填“漏气”、“不漏气”或“无法确定”),理由是_____________________________。
(2)关闭B装置中的止水夹a后,开启活塞b,水不断往下流,至全部流入烧瓶,判断B装置是否漏气_____(填“漏气”、“不漏气”或“无法确定”),理由是______________________________。
(3)用简单的方法检验C装置的气密性__________________________________________________。
如图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合,及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。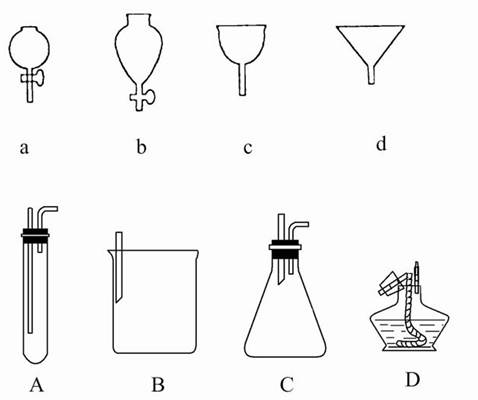
① A与____组合,用于____________________,
② B与____组合,用于____________________,
③ B与____组合,用于____________________,
④ D与____组合,用于____________________。