(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 |
炭粉(C) |
一氧化碳(CO) |
氢气(H2) |
甲烷(CH4) |
乙醇(C2H5OH) |
| 状态 |
固体 |
气体 |
气体 |
气体 |
液体 |
| 热量(kJ) |
392.8 |
282.6 |
285.8 |
890.3 |
1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面(S)和时间(t)的变化曲线如图所示。据此判断:
①在T2温度下,0~2 s内的平均反应速率v(N2)=________。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____________。
(2)煤燃烧产生的烟气中有含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①已知甲烷的燃烧热为890 kJ·mol-1;1 mol水蒸气变成液态水放热44 kJ;N2与O2生成NO的过程如下,
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=________。
②在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有________。
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有________。
| A.增加原催化剂的表面积 |
| B.降低温度 |
| C.减小投料比[n(NO2)/n(CH4)] |
| D.增大压强 |
(3)在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生上述的两个反应:并在t秒时测定其中NOx转化率,绘得图像如下图所示:
从图中可以得出的结论是_____________________。
结论一:在250~450 ℃时,NOx转化率随温度升高而增大,450~ 600 ℃时NOx转化率随温度升高而减小推测原因是______________________________________。
结论二:__________________________________。
[化学与技术]
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: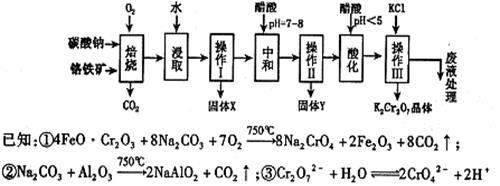
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据。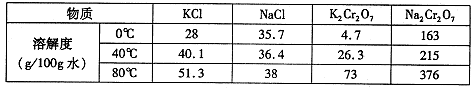
操作III发生反应的化学方程式是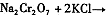
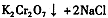 。该反应在溶液中能发生的理由是 。
。该反应在溶液中能发生的理由是 。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
[物质结构与性质]
(1)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是 (填写序号)
a.H3O+ b.H2O c.NO2+ d.NO2﹣
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为 .P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为 (用化学式填写)
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为 Q2+的未成对电子数是 .
(4)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是图1中的 .
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有 (填序号).
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键,若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)
①平面正方形②正四面体③三角锥形④V形。
(6)X与Y可形成离子化合物,其晶胞结构如图2所示.其中X和Y的相对原子质量分别为a和b,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是
cm(NA表示阿伏伽德罗常数,用含ρ、a、b、NA的代数式表达)
下图I中表示在2L的密闭容器中、T1温度下,某可逆反应各物质浓度与时间关系;图II表示当其它条件不变时,C物质的体积分数(C%)与温度(T)和压强(p)的关系。回答下列问题:
(1)该可逆反应的化学方程式为 。
(2)上述反应的压强p1 p2,反应的焓变△H 0(填“大于”、“小于”或“等于”)
(3)若温度T1时,5min后反应达到平衡,则
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。(列式计算)
③反应在0~5min区间的平均反应速率v(B)= 。
X、Y、Z、M和N均为短周期元素,X、Y、Z原子序数依次增大且最外层电子数之和为15,X与Z可形成XZ、XZ2型分子, Y与M气态化合物标准状况下密度约0.76g/L。N的原子半径为短周期元素中最大。回答下列问题:
(1)M、Z和N的元素符号分别为 、 、 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序为 。
(3)由上述元素组成、既含有共价键又含有离子键的化合物,其中含有极性共价键或含有非极性共价键,各举一例用电子式表示为 、 。
(4)X和Y组成的离子XY-对环境有害,可在NaClO的碱性溶液中转化为碳酸盐和氮气,相应的离子方程式为 。