[物质结构与性质]
(1)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是 (填写序号)
a.H3O+ b.H2O c.NO2+ d.NO2﹣
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为 .P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为 (用化学式填写)
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为 Q2+的未成对电子数是 .
(4)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是图1中的 .
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有 (填序号).
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键,若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)
①平面正方形②正四面体③三角锥形④V形。
(6)X与Y可形成离子化合物,其晶胞结构如图2所示.其中X和Y的相对原子质量分别为a和b,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是
cm(NA表示阿伏伽德罗常数,用含ρ、a、b、NA的代数式表达)

某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第次检测结果不正确。
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加溶液(填化学式),其目的是。
第二,继续加入过量的该溶液,其目的是。
第三,再向溶液中加入溶液(填化学式),确定离子的存在,其离子反应方程式为。
将1mol/L的FeCl3溶液逐滴滴入沸水中,液体变为色,得到的是;反应的化学方为。向其中逐滴加入稀硫酸至过量,现象是,原因是。
如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,
切断K1,闭合K2、K3,通直流电,则: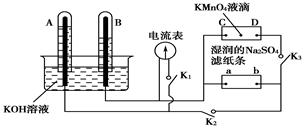
(1)标出电源的正、负极,a为________极。
(2)在湿的Na2SO4滤纸条中心滴KMnO4溶液,现象为___________________________。
(3)写出电极反应式:A中_____________________________________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1。电流表的指针偏转,则此时A极电极反应式为__________________________。
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________.
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(10分)“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO
和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向进行(填“左”或“右”),判断依据是。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。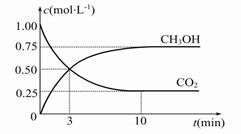
①从反应开始到平衡,氢气的平均反应速率v(H2)=。
②反应达到平衡后,下列措施能使[CH3OH]∕[CO2]增大的是(填符号)。
| A.升高温度 |
| B.再充入H2 |
| C.再充入CO2 |
| D.将H2O(g)从体系中分离 |
E.充入He(g)