[化学与技术]
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
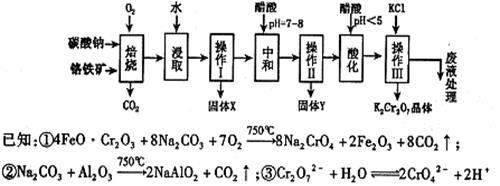
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据。
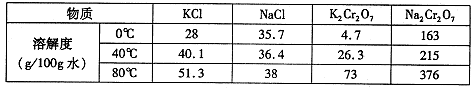
操作III发生反应的化学方程式是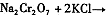
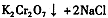 。该反应在溶液中能发生的理由是 。
。该反应在溶液中能发生的理由是 。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)检验氧化铜被氢气充分还原后,所得产物中是否含有氧化亚铜的的方法是:
;
(2)现有8 g氧化铜被氢气充分还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是;
(3)若将6.8 g上述混合物全部溶解在稀硝酸中,
①写出Cu2O与稀硝酸反应的离子方程式;
②如果所得溶液体积为200mL,所得溶液的物质的量浓度为mol/L;
(4)将上述所得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68 g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式(要求:写出本小题的计算过程)。
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成: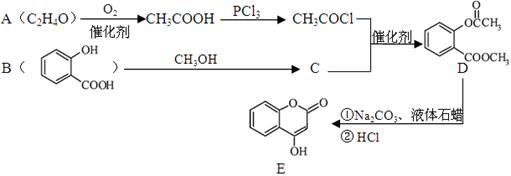

(1)A中含有的官能团名称为。
(2)C转化为D的反应类型是。
(3)写出D与足量NaOH溶液完全反应的化学方程式。
(4)1摩尔E最多可与摩尔H2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式。
A.能发生银镜反应。 B.核磁共振氢谱只有4个峰。
C.能与FeCl3溶液发生显色反应,水解时每摩尔可消耗3摩尔NaOH。
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。
苯甲酸苯酚酯(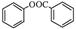 )是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
)是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
合成路线流程图示例如下:
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: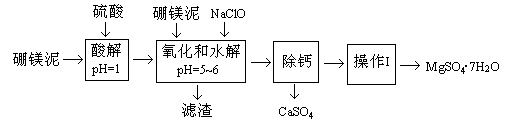
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤、。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为。
工业上制取铝的流程如下:
注:冰晶石的作用是使E在较低温度下熔化。
(1)试写出下列物质的化学式:
A,B,C,D,E。
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
| Al2O3 |
Fe2O3 |
Na2O |
|
| 铝土矿 |
55% |
16% |
0% |
| 赤泥 |
15% |
48% |
8% |
试求制取1t Al2O3所需铝土矿和苛性钠的质量。(写过程)
仔细体会下列有机合成过程中碳骨架的构建及官能团的引入和转化,完成下题:
已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为:。E中含氧官能团的名称为。
(2)反应①~⑥中符合原子经济性的是。
(3)写出下列转化的化学方程式:②,③。
写出有关反应的类型:②⑥。
(4)符合下列要求的E物质的同分异构体有种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。