化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成: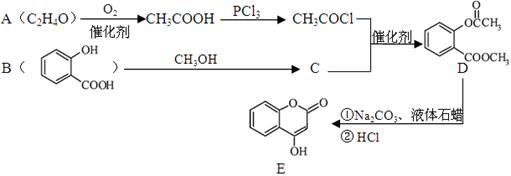

(1)A中含有的官能团名称为 。
(2)C转化为D的反应类型是 。
(3)写出D与足量NaOH溶液完全反应的化学方程式 。
(4)1摩尔E最多可与 摩尔H2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式 。
A.能发生银镜反应。 B.核磁共振氢谱只有4个峰。
C.能与FeCl3溶液发生显色反应,水解时每摩尔可消耗3摩尔NaOH。
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。
苯甲酸苯酚酯(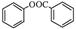 )是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
)是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
合成路线流程图示例如下:
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是。
(2)为了充分利用反应放出的热量,接触室中应安装(填设备名称);吸引塔中填充许多瓷管,其作用是。
(3)吸收塔排放的尾气中含有少量的SO ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
传统的方法是:尾气中的SO 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:,其优点是。
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:,其优点是。
创新方法是:将尾气中的SO 用Na
用Na SO
SO 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式: ,创新方法与传统方法相比,其优点是 。
,创新方法与传统方法相比,其优点是 。
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是(填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO 与杂质反应 与杂质反应 |
B.硫酸生产中常采用高压条件,目的是提高SO 的转化率 的转化率 |
C.SO 被氧化为SO 被氧化为SO 时需要使用催化剂,这样可以提高SO 时需要使用催化剂,这样可以提高SO 的转化率 的转化率 |
D.SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 吸收完全 吸收完全 |
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气m ( O
( O 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。
下表是实验室制备气体的有关内容:
(1)上述气体中,从制备过程看,必须选择合适的氧化剂才能实现的是(填气体的化学式);从反应原理看,明显不同于其它两种气体的是(填气体的化学式);从收集方法来看,只能用一种方法收集的是(填气体的化学式)。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其选项填入表中相应编号的空格中。
(3)若用上述制备NH 的
的 装置制备O
装置制备O ,则选择的试剂为(填化学式);若用上述制备O
,则选择的试剂为(填化学式);若用上述制备O 的装置制备NH
的装置制备NH ,则选择的试剂的名称为。
,则选择的试剂的名称为。
(4)若用排空气法收集Cl ,请画出气体收集装置图。
,请画出气体收集装置图。
(5)有下列无机物的转化关系,已知B和Y是上述三种气体中的两种。
a.当w为MnO 时,反应①不加热就能反应,反应④加热才能顺利进行,写出反应①的化学方程式。
时,反应①不加热就能反应,反应④加热才能顺利进行,写出反应①的化学方程式。
b.当w为KMnO 时,反应①加热才能进行,反应④不加热就能
时,反应①加热才能进行,反应④不加热就能 进行,写出反应④的离子方程式。。
进行,写出反应④的离子方程式。。
(6)已知 ,现向100mL的
,现向100mL的 溶液中通入标准状况下Cl
溶液中通入标准状况下Cl 3.36L,充分反应后,测得溶液中
3.36L,充分反应后,测得溶液中 与
与 的物质的量浓度相等(设通入Cl
的物质的量浓度相等(设通入Cl 前后溶液体积不变),则原
前后溶液体积不变),则原 溶液中溶质的物质的量浓度为。
溶液中溶质的物质的量浓度为。
在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H O外,还有H
O外,还有H O
O ;碳元素的氢化物除CH
;碳元素的氢化物除CH 外,还有C
外,还有C H
H 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N H
H 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为。
(2)该系列中的N H
H 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N H
H 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式:。
(3)该系列物中的NH 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为:



I.在一定温度下,将1.5molN 和6 molH
和6 molH 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为kJ.
H 的转化率=。
的转化率=。
该温度下合成氨反应的平衡常数 =(只列数字表达式)
=(只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN 、bmolH
、bmolH 、cmolNH
、cmolNH ,平衡时NH
,平衡时NH 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量(填字母代号)
| A.一定相等 |
| B.前者一定小于后者 |
| C.前者等于或小于后者 |
| D.前者等于或大于后者 |
I和II合成氨的平衡常数分别为 和
和 ,同
,同
 (填“﹥”、“﹤
(填“﹥”、“﹤ ”或
”或 “=”)
“=”)
欲使开始时反应正向进行,a的取值范围为 。
各物质之间的转化关系如下图,图中部分生成物省略,有相关信息如下:
①X为红褐色沉淀;②A为单质,B为溶液,D和F为气体;③反应I的产物只有Y和H O;
O;
④B、D、F和Y中均含有同一元素。
请回答下列问题:
(1)组成A的元素在周期表中属于 (选填序号)。
A.主族元素 B.副族元素 C.短周期元素 D.过渡元素
B.副族元素 C.短周期元素 D.过渡元素
(2)写出溶液B中溶质的化学式:。
(3)写出反应I的化学反应方程式:。
(4)以石墨为两极 材料,电解C的滴水溶液,写出电解初期阴极的电极反应式:。
材料,电解C的滴水溶液,写出电解初期阴极的电极反应式:。
(5)28g单质A与一定浓度的B溶液反应,当生成n(C):n(E)=2:3时,反应中转移电子mol.
(6)给E溶液中加入 也能生成X,写出当n(E):n(
也能生成X,写出当n(E):n( )=1:1时,反应的离子方程式 。
)=1:1时,反应的离子方程式 。
盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。合成路线如下: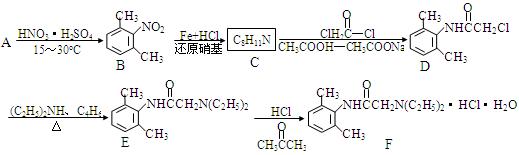
(1)C→D的反应类型是。
(2)A的结构简式为;C的结构简式为;
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有种。
①属于苯的衍生物,苯环上共有二个取代基;
②与碳酸钠溶液反应可放出CO2气体,并且有—NH2基团
(4)写出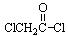 与足量的NaOH溶液共热充分反应的化学方
与足量的NaOH溶液共热充分反应的化学方 程式:。
程式:。
(5)现仅以有机物CH3CH=CHCH3为原料,无机试剂任选,用反应流程图表示合成有机物CH3COOCH2CH=CHCH2OOCCH3的过程。
提示:①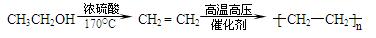
②由乙醇合成聚乙烯的反应流程图可表示为:
提示:CH2=CH—CH=CH2与Br2反应有两种加成方式:一是1,2-加成;二是1,4-加成。