高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式: 。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是 。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
图Ⅰ 图Ⅱ
根据上图分析:工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
(12分)(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池。该电池中负极发生________反应(填“氧化”或“还原”);溶液中的H+移向________(填“正极”或“负极”)材料。
(2)电能是现代社会应用最广泛的能源之一。下图所示的原电池装置中,其负极是__________,正极上能够观察到的现象是____________________________,正极的电极反应式是______________。原电池工作一段时间后,若消耗锌6.5g,则放出气体_______g。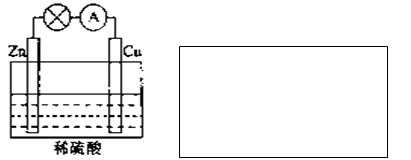
(3)利用下列反应:Fe+2Fe3+=3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向。
(1)已知断开1 mol N≡N键需要946 kJ的能量,断开1 mol H—H键需要436 kJ的能量,生成1 mol N—H键放出391 kJ的能量,试计算生成2 mol NH3时会________(填“放出”或“吸收”)________kJ能量。
(2)当在相同的条件下向容器中充入1 mol N2和3 mol H2时,它们反应对应的热量________(填“大于”、“等于”或“小于”)你所计算出的值,原因是__________________________。
(1)能源是现代社会发展的支柱之一。化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是___________(填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
(2)某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是______________。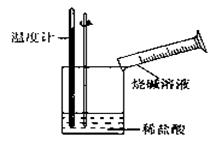
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示: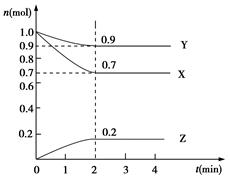
(1)X的转化率是________;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=________;
(4)当反应进行到第________min,该反应达到平衡。
下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑨ |
⑩ |
||
| 4 |
② |
④ |
(1)10种元素中,化学性质最不活泼的是___________;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是__________;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为___________;该氢化物常温下和元素①的单质反应的化学方程式_____________________________;
(4)元素⑧的最高价氧化物对应水化物的化学式为________;元素⑨的最高正化合价为__________,氢化物的化学式为_____________;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为________________。