下列说法正确的是
| A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 |
| C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器 |
| D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
下列说法正确的是( )
| A.硅单质广泛用于光纤通讯 | B.水晶项链是硅单质制品 |
| C.利用盐酸刻蚀石英制作艺术品 | D.硅酸钠可用于制备木材防火剂 |
如图所示Cu-Zn原电池,下列叙述正确的是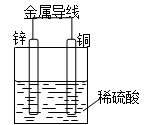
| A.锌为负极,发生氧化反应 |
| B.铜为负极,铜片上有气泡产生 |
| C.电子由铜片通过导线流向锌片 |
| D.溶液中的H+从铜片获得电子被还原成氢原子 |
下图装置可用于收集某气体并验证其某些化学性质,你认为正确的是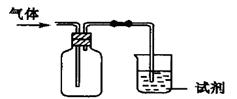
| 选项 |
气体 |
试剂 |
现象 |
结论 |
| A |
Cl2 |
紫色石蕊试液 |
溶液先变红后褪色 |
氯水有酸性和漂白性 |
| B |
NH3 |
水 |
无明显现象 |
NH3能溶于水 |
| C |
X |
澄清石灰水 |
溶液变浑浊 |
气体可能是CO2 |
| D |
SO2 |
酸性KMnO4(aq) |
溶液褪色 |
SO2有漂白性 |
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图。下列叙述中正确的是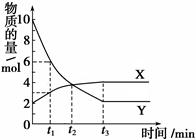

| A.反应的化学方程式为4X Y |
| B.当t1=2时,用X表示该反应在2min内的平均反应速率为0.25mol / (L·min) |
| C.t2时,正反应速率等于逆反应速率 |
| D.t3时,Y浓度不再变化,反应达到平衡 |
下列化学反应方程式或离子方程式书写正确的是
| A.乙烯制溴乙烷: CH2CH2 + Br2→ CH2BrCH2Br |
B.乙醇催化氧化:2CH3CH2OH + O2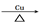 2CH3COH + 2H2O 2CH3COH + 2H2O |
C.苯与氢气加成: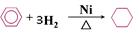 |
| D.从海带中提取碘:H2O2 + 2I- + 2H+ = I2 + 2H2O |