氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:

①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K (填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。

(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,操作步骤有:①在天平上称取27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水把它完全溶解。②把制得的溶液小心地注入500 mL容量瓶中。③继续向容量瓶中加入蒸馏水,至液面距刻度1 cm—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号):____________________________________________。
(2)本实验用到的基本仪器有:__________________________________________________。
(3)若俯视刻度,对所配制溶液浓度的影响是______________(填“偏低”“偏高”或“无影响”)。
(4)若没有进行④的操作,其影响是________________________________________________。
(5)若实验中出现了下列情况应如何处理:加蒸馏水时不慎超过了刻度,应________________,向容量瓶中转移溶液时(实验步骤②)不慎有液滴溅在容量瓶外面,应____________________。
某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。
(1)假如你是小组成员,根据你的推测,浓硫酸与木炭粉在加热条件下反应的产物的可能是。
(2)为了验证你的推测,小组讨论确定用以下装置进行实验: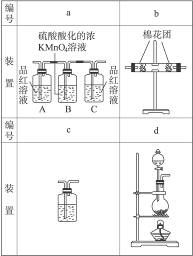
①你认为装置b中所加的固体是_____________;装置C中所加的溶液是_____________。
②甲、乙、丙三位同学分别设计了三套不同的装置如下:
甲的装置顺序:d a b c
乙的装置顺序:d b a c
丙的装置顺序:d c a b
你认为谁设计的顺序合理?为什么?推测合理的顺序中的a、b、c装置中可能出现的实验现象。
设计一个只用BaCl2溶液及试管鉴别Na2SO3溶液和稀硫酸的实验,简要写出鉴别过程。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。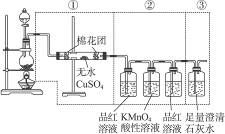
(1)如图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质是__________;不能检验出的物质是__________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是__________;不能检验出的物质是__________。
(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是__________;不能检验出的物质是__________。
为验证木炭可被浓硫酸氧化成二氧化碳,选用下图中仪器(含所盛物质)组装成套实验装置,试完成下列问题。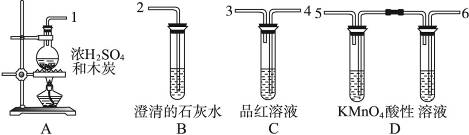
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该是____________接____________,____________接____________,____________接____________。
(2)试管B、C中各有什么现象,才能表示已检出二氧化碳?
B中_________________________________,C中__________________________________。
(3)试管D中能否用饱和NaHCO3溶液代替KMnO4酸性溶液?说明理由。