下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。

(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。

(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。

请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
实验室中可用如图装置来制取干燥的氨气。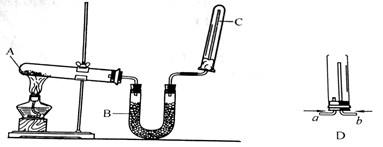
(1)写出A处发生反应的化学方程式;
(2)U形管B中所放的药品是;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是。
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)试管C的管口处要放置一小团棉花,放置棉花的作用是;
(5)资料显示:“氨气可在纯氧中点燃,反应生成氮气和水”。为验证此事实,某同学设计了一个实验方案,装置见D。请写出该反应的化学方程式。
在面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。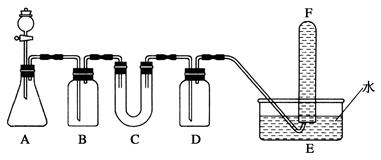
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:。
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:。
(4)试管F中收集满气体后,下一步实验操作是。
(11分)为证明有关物质的性质,某学生设计了如图所示的装置。当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮。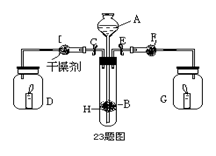
(1)请判断各仪器中盛放的物质的化学式:
A; B;F。
(2)用化学反应方程式表示上述有关反应(不包括蜡烛的燃烧):
,
,
.
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。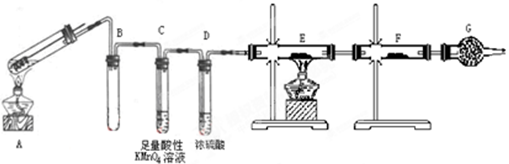
(1)填写装置的作用:
B ,
C,
G。
(2)先点燃处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作。
(3)证明有SO2生成的现象是。
(4)可以证明气体X中含有氢气的实验现象是:________________________。
如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是____________________。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量(填“相等”、“不相等”),若实验操作均正确,则所求中和热填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中