(14分)某研究小组为了探究SO2的实验室制法和有关化学性质,设计了如下的实验。
实验I:

(1)实验基本操作分析:
①多孔隔板与活塞相配合,能起到的作用是_________________________________.
②该实验制H2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H2所起的作用是_____________________________.
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO4溶液,观察到酸性KMn O4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO2被Fe3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨 B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO2被Fe3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO2催化氧化为SO3的转化率,又设计了如下实验:已知SO3熔点为16.8℃,且忽略空气中CO2的影响).

①当停止通入SO2,熄灭酒精灯后,需要继续通入氧气,其目的是________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。
(10分)I、按下图装置,持续通入气态物质X,可以看到a处有红色物质生成,b处变蓝,c处得到无色液体可用于其它实验。
①X可能是(从所给物质中选取,填代号)
| A.H2 | B.CH3CH2OH(g) | C.NH3 | D.CO和H2 |
写出在a中所进行反应的反应方式。
②实验中C处U型管浸没在冰水中,使用冰水的目的是:。
③该实验装置有一明显缺陷,请指出:。
Ⅱ、某同学偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
某化学课外小组用下图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。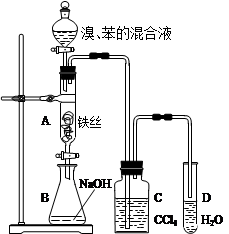
(1)写出A中反应的化学方程式:________________________________________ 。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_________________________。
(4)若要证明苯和液溴发生的是取代反应,而不
是加成反应,通常有两种方法,请按要求填写下表。
| 向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
|
| 方法一 |
||
| 方法二 |
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
| 实验操作 |
实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 |
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 |
C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是________________________________________。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是____________。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是___________________________________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是________。
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示: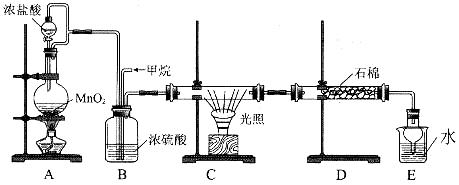
(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将l mol CH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
利用下图装置验证同主族元素非金属性的变化规律。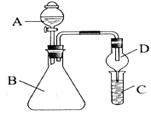
(1)若要证明非金属性:C1>I,A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C溶液中的现象是_________,即可证明。可用_________溶液吸收尾气。
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,观察到C中溶液的现象是__________,即可证明。但有的同学认为盐酸具有挥发性,应用_________溶液除去。