【2015重庆理综化学】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
①,②,③,④,⑤,⑥。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出:。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响:,原因是:。
就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法:。
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂,是还原剂,元素被氧化,元素被还原,若0.3mol氯气生成则若0.3mol氯气生成转移的电子数目为。
在300 mL2mol/LH2SO4溶液中,溶质的质量是,此溶液中含H+的物质的量是,H+的物质的量浓度是,其中含有个SO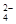 ,SO
,SO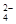 的物质的量浓度是。
的物质的量浓度是。
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: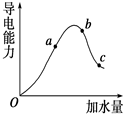
(1) “O”点为什么不导电________.
(2)a,b,c三点的pH由小到大的顺序是____________.
(3) a、b、c三点中电离程度最大的是
电离平衡常数Ka、Kb、Kc的大小关系为________.
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的 ________(填序号).
A加热;B加很稀的NaOH溶液;C加NaOH固体;D加水;E加固体CH3COONa;F加入锌粒