【2015福建理综化学】[化学-有机化学基础]“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物
b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色
d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:
已知:
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________.
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。
试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
(1)同主族内不同元素的E值变化的特点是__________。各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是__________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:__________<E<__________。
(4)10号元素E值较大的原因是______________________________。
最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料完成下列问题:
(1)铷Rb37位于周期表的第__________周期,第__________族。
(2)关于铷的结构和性质判断正确的是( )
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
A.①③④ B.②③⑤ C.②④ D.①③⑤
(3)氢化铷与水反应可放出氢气,则下列叙述正确的是( )
A.氢化铷溶于水显酸性
B.氢化铷中氢离子被还原为氢气
C.氢化铷与水反应时,水是还原剂
D.氢化铷中氢离子最外层有两个电子
(4)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是( )
A.Li B.Na C.K D.Cs
一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。请查阅下列化合物中元素的电负性数值,判断它们哪些是共价化合物。
(1)NaF (2)AlCl3 (3)NO (4)MgO (5)BeCl2 (6)CO2
共价化合物____________________________________________________________。
离子化合物____________________________________________________________。
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
已知元素的电负性和元素的化合价等一样,也是元素的一种基本性质。下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____________________。
(2)判断下列物质是离子化合物还是共价化合物?
Mg3N2 BeCl2 AlCl3 SiC
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。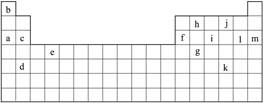
(1)下列__________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响。
原子核失去核外不同电子所需的能量(kJ·mol-1):
| 锂 |
X |
Y |
|
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7 296 |
4 570 |
1 820 |
| 失去第三个电子 |
11 799 |
6 920 |
2 750 |
| 失去第四个电子 |
— |
9 550 |
11 600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量__________________________________________________。
②表中X可能为以上13种元素中的__________(填写字母)元素。用元素符号表示X和j形成的化合物的化学式__________。
③Y是周期表中__________族的元素。
④以上13种元素中,__________(填写字母)元素原子失去核外第一个电子需要的能量最多。