一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。请查阅下列化合物中元素的电负性数值,判断它们哪些是共价化合物。
(1)NaF (2)AlCl3 (3)NO (4)MgO (5)BeCl2 (6)CO2
共价化合物____________________________________________________________。
离子化合物____________________________________________________________。
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是(全对得分,下同)
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是。
(3)过滤时,应选用上述仪器中的(填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在(填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _(填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
(14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是________.
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为0.25 mol/L,试判断此时的温度为________℃.
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________.
a.等于1.0 mol
b.大于1.0 mol
c.大于0.5 mol,小于1.0 mol
d.无法确定
含苯酚的工业废水处理的流程图如下所示: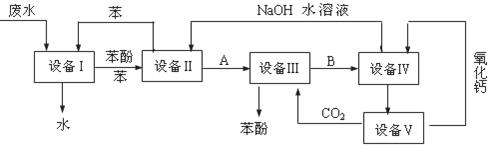
(1)上述流程里,设备Ⅰ中进行的是______________操作(填操作名称),实验室里这一步操作可以用_______________进行(填仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是__________,由设备Ⅲ进入设备Ⅳ的物质B是
(3)在设备Ⅲ中发生反应的化学方程式为。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和,通过操作(填操作名称)可使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、、。
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。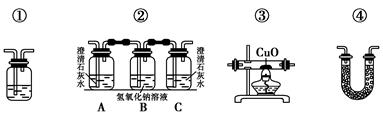
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________________;B瓶溶液的作用是________________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________________;装置①中所盛放的是________________,作用是_______________________________________。
(5)装置④中所盛的固体药品是______________,它可以验证的产物是_____________。
(6)尾气应如何处理?___________________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。