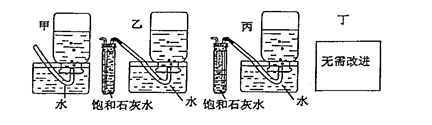
下图是实验室制取气体的装置图(固定装置省略),请回答下列问题:

(1)仪器名称:a ,b 。
(2)B图的装置可用来制取一种具有助燃性的气体,写出制取该气体的化学方程式: ,该装置操作上的优点是 。
D装置操作上的优点是 。
(3)写出实验室用高锰酸钾制取氧气的化学方程式 ,若用E收集一瓶干燥的氧气,其中Ⅰ瓶中盛放的试剂是 (填名称),并将图E补充完整。
(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_________(填字母)。
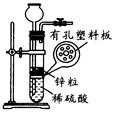
| A.氢氧化钠溶液 | B.碳酸钠溶液 |
| C.硫酸钠溶液 | D.澄清石灰水 |
二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为:,氧化产物与还原产物的物质的量之比为 。
(2)控制水浴温度在60~80℃之间的目的是,图示装置中缺少的一种必须的玻璃仪器是。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的化学方程式。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)、 配制250mL0.1mol/L的盐酸溶液
| 应称量盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需的其它仪器 |
(2)、配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)、操作A中,将洗涤液都移入容量瓶,其目的是,溶液注入容量瓶前需恢复到室温,这是因为_____________________;
(4)、若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响” )
若没有进行A操作;若加蒸馏水时不慎超过了刻度;
若定容时俯视刻度线 _______________。
(5)、若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀产生;(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成;(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现;(4)另取少量步骤(3)中的滤液,加入NaOH溶液至溶液显碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有离子,一定不含有 离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(只填写实验名称和观察到的现象)
乙醇在浓硫酸的作用下,加热到170℃时生成乙烯。某实验小组同学根据此反应设计了右图装置制取乙烯。请回答: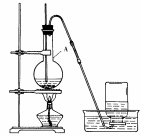
(1)仪器A的名称是。
(2)收集乙烯的方法是。
(3)加热前烧瓶中应加入碎瓷片,其目的是。
(4)该反应的化学方程式为 ,反应类型是(填序号)。a.加成反应 b.消去反应
(5)将生成的乙烯通入高锰酸钾酸性溶液中,观察到的现象是(填序号)。
a.溶液紫色褪去 b.没有明显现象
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图: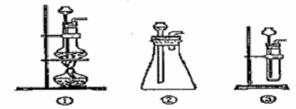
B装置的作用是,C装置内可能出现的现象是。为了检验E中收集到的气体,在取出集气瓶后,用的木条伸入集气瓶内,木条会出现。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值(答大或小),这是由于:____________________________________________。
(5)你认为上述A-E的实验装置中,E部分是否安全、合理E是否需要改为下列四项中的哪一项:。(用甲、乙、丙、丁回答)