在推断实验室无色废液的成分时,四位同学得出了四种结论,其中可能合理的是
| A.NaCl、CuSO4、NaNO3 | B.NaCl、K2SO4、NaOH |
| C.HCl、NaOH、CaCl2 | D.K2CO3、KNO3、BaCl2 |
关于下列装置说法正确的是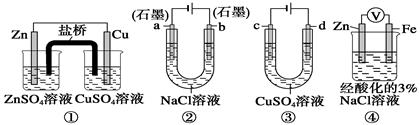
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
将纯水加热到较高温度,以下叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离子积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
下列叙述中,能证明某物质是弱电解质的是
| A.熔化时不导电 |
| B.不是离子化合物,而是极性共价化合物 |
| C.溶液中已电离的离子和未电离的分子共存 |
| D.水溶液的导电能力很差 |
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量②氨水过量③恰好完全反应 ④c (NH4+) = c(Cl-)⑤c (NH4+) < c(Cl-) 正确的是
| A.②④ | B.③④ | C.②⑤ | D.①⑤ |