已知镁粉与冷水几乎不反应,与热水反应缓慢。市场上购买的“即热饭盒”底部有两层,一层装水,另一层是镁粉与铁粉的混合物,当水与金属粉末接触时会发生反应Mg+2H2O=Mg(OH)2+H2↑。则下列说法不正确的是
| A.“即热饭盒”的工作原理是将化学能转化为热能 |
| B.上述反应中,反应物的总焓大于生成物的总焓 |
| C.铁粉的作用是催化剂 |
| D.上述反应的反应热Q为正值 |
下列化学用语正确的是
| A.乙酸的结构简式:C2H4O2 |
B.氮气的结构式:N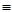 N N |
C.硫化氢的电子式: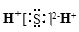 |
D.氯原子的结构示意图: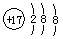 |
“纳米材料”是指直径从几纳米至几十纳米的材料,目前已广泛应用于催化剂及军事技术中,如果将纳米材料分散到液体分散剂中,所得混合物
| A.“纳米材料”实质是分子材料 |
| B.“纳米材料”是电解质 |
| C.该混合物外观完全不同于溶液 |
| D.有丁达尔效应 |
900℃时,向1.0L恒容密闭容器中充入0.40mol乙苯,发生反应: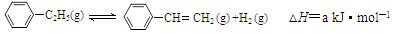 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前10 min的平均速率为v(H2)=0.01mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(H2)=0.22mol·L-1,则a<0
C.保持其他条件不变,压缩容器的体积为原来的一半,则乙苯的转化率大于50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.20molH2,达到平衡前v(正)>v(逆)
常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 NaHCO3溶液:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
| A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小 |
| B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱 |
| C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼 |
| D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成 |