常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 NaHCO3溶液:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是()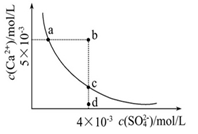
| A.常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/L Na2SO4溶液后,溶液中无沉淀析出 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
D.a 点对应的Ksp等于c点对应的Ksp 点对应的Ksp等于c点对应的Ksp |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g)△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g)△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是()
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
已知:NaA水溶液呈碱性,常温下将0.10molNaA和0.05molHCl溶于水,得到PH<7的溶液,则溶液中离子浓度关系正确的是()
A.c(A-)+c(OH-)=c(Na+)+c(H+) B.c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(HA)+c(A-)=2c(Na+) D.c(Na+)>c(Cl-)>c(A-)>c(H+)
下列说法或表示法正确的是()
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol |
| C.温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
| D.若溶液中存在c(H+)=c(OH-)=10-6 mol/L,则该溶液一定呈中性 |
13.化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是()
B.CaCO3(s)=CaO(s)+CO2(g)△S>0
C.用纯碱溶液洗涤餐具的原因,用离子方程式表示:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D.BaSO4悬浊液中存在平衡:BaSO4(s)  Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)