分析原子的杂化方式,并根据等电子体原理判断下列各组分子中的所有原子,或者处于同一平面,或者在一条直线上的是
| A.C2H2、HClO、C2H6 | B.CO2、N2O、HC≡C—NH2 |
| C.C6H5CH3、C3H4、CH4 | D.C6H6、C2H4、HCN |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中不正确的是
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42 |
| B.b点对应的溶液中大量存在:Na+、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3- |
| D.d点对应的溶液中大量存在:Na+、K+、SO32-、Cl— |
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)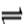 Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是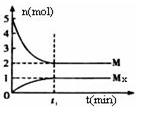
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,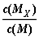 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
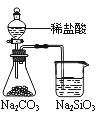
下列实验能达到目的的是
| 实验 |
 |
 |
 |
 |
| 目的 |
证明铁生锈过程 中空气参与反应 |
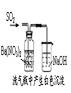
证明非金属性 Cl>C>Si |
制取BaSO3, 并吸收尾气 |
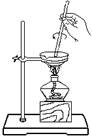
从碘水中 分离出碘 |
| 选项 |
A |
B |
C |
D |
常温时,下列溶液的pH或微粒的物质的量浓度关系不正确的是
A.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A一)=2c(H+)+c(HA)
B.某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a
D. pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR一)=c(Na+)
设阿伏加德罗常数的数值为NA,下列说法正确的是
| A.28g乙烯分子中含有极性共价键的数目为6NA |
| B.一定条件下,0.1molCu与0.1molI2充分反应,转移的电子数一定为0.2NA |
| C.标准状况下,11.2L以任意比例混合的NO和O2的混合气体中所含原子个数为NA |
| D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |