电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液。工作时电池总反应为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。
(1)工作时电流从 极流向 极(两空均选填“Ag2O”或“Zn”);
(2)负极的电极反应式为: ;
(3)工作时电池正极区的pH (选填“增大”“减小”或“不变”);
(4)外电路中每通过0.2 mol电子,锌的质量理论上减少 g。
如图Ⅰ,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(?)+B(?) x C(g);ΔH<0
x C(g);ΔH<0
平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。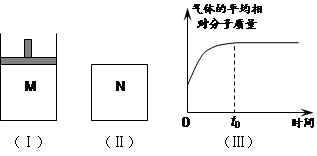
⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
| 可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 (M表示摩尔质量) |
|
| A |
B |
|||
| ① |
是 |
不是 |
z =y |
不确定 |
| ② |
||||
| ③ |
已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:

现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
试回答下列问题:
⑴ X为(填元素符号);
⑵A中所含的官能团为,上述转化中其中属于氧化反应的共有步(填数字);M与NaOH溶液共热反应的所属类型是反应。
⑶ M的结构简式为。
⑷写出下列反应的化学方程:
①B→D;
②D在一定条件下发生加聚反应:;
③E和银氨溶液反应的化学方程式:。
在星际云中发现一种高度对称的有机分子Z,Z在紫外线辐射或加热的条件下可转化为其他许多生命物质,这些事实支持了生命来自星际的假说。有人认为,Z的形成过程如下:
(1)星际分子CH2==NH聚合生成X;
(2)X分子中N-H键与甲醛加成得到Y(化学式为C6H15O3N3);
(3)Y与氨(物质的量之比1:1)脱水缩合得到Z。
试写出X、Y、Z的结构简式:
X_________________、Y_________________、Z________________。
下图中,甲、乙、丙、丁、戊分别表示中学化学常见的一种单质,其他字母分别表示一种化合物。反应①的原理在工业生产例如冶金工业上有重要的应用。
请按要求填空:
(1)甲的原子结构示意图是,丁的电子式是,沉淀I的化学式是。
(2)反应①的化学方程式是。
反应②的离子方程式是。
臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝。化学方程式为:
KI+O3+H2O——KOH+I2+O2(未配平)
(1)该反应中氧化剂的名称为,还原产物的化学式为;
(2)若消耗0.1 mol氧化剂,反应中转移电子的物质的量为__________________。