前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。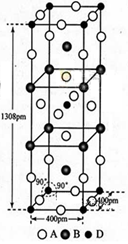
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是。
氯丁橡胶E(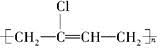 )的合成路线如下:
)的合成路线如下:
已知 是不稳定结构。
是不稳定结构。
(1)氯丁橡胶中官能团的名称是________。
(2)②的反应条件和无机试剂是________。
(3)若A为反式结构,用结构简式表示A的结构是____________。
(4)④的化学方程式是______________________。
(5)B的同分异构体有多种,写出属于酯类且能发生银镜反应的所有同分异构体的结构简式:____________________。
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为___________、______________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:
ⅰ.H2O2ⅱ.调pHNaClO/NaOH混合溶液
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。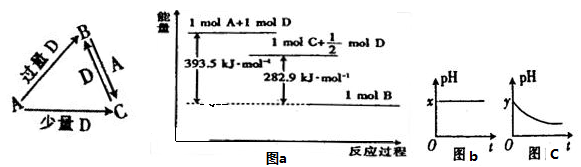
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为;
②反应B+A→C的离子方程式为;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为;
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式;