已知A、B、C、D都是含有碳、氢、氧三种元素的有机物,其中A、C分别是白酒和食醋中含有的成分,A、B、C、D间有如下转化关系:
请回答下列问题:
(1)B物质中官能团为 。
(2)写出A与C在浓H2SO4存在条件下加热反应生成D的化学方程式: 。
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:
①C(s) + H2O(g) === CO(g)+H2(g)ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g)ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为。
该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
| 时间(min) 浓度(mol·L-1) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①10~20min内,N2的平均反应速率v(N2)=。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母序号)。
A.通入一定量的NOB.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
选考[化学—有机化学基础](13分)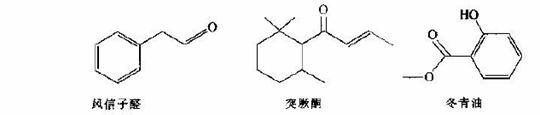
(1)可鉴别风信子醛和突厥酮的试剂是。
(2)下列关于风信子醛和突厥酮的说法中正确的是(填序号)。
a.都属于芳香族化合物b.都能使酸性高锰酸钾溶液褪色
c.突厥酮的分子式为C13H20Od风信子醛不能发生加成反应
(3)突厥酮与嗅水反应的化学方程式为。
(4)芳香烃A发生如下反应生成F: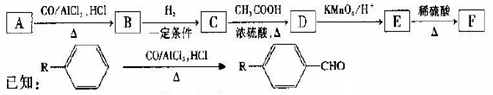
F与冬青油互为同分异构体。请回答:
①若A的分子式为C10 H14,则能实现上述转化的A的同分异构体有种
②C→D的反应类型为。
③设汁C→D和E→F步骤的目的为。
④F生成高聚物的化学方程式为。
选考〔化学—物质结构与性质](13分)
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,
反应原理为: 2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的核外电子排布式为_
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为(填元素符号)。
(3)已知H2.S2O8的结构如图。
①H2.S2O8硫原子的轨道杂化方式为。
②上述反应中被还原的元素为。
③上述反应每生成1 mol MnO4 -,S2O82- 断裂的共价键类型及其数目为。
(4)一定条件下,水分子间可通过O一H...O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①下图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为;
②实验测得冰中氢键的作用能为18.8目kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是。
(15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是(填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
①步骤I中,反应温度不宜过高的原因是。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为。
③步骤II中,物质X可选用的物质是。(填序号)。
a.Cub.C12c.H2O2d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是_。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s)  Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q) CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
(15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是(填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是(填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈。