(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
嫦娥二号运载工具长三丙火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出257KJ的热量。
(1)反应的热化学方程式为 __________________。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点。
(1)下列装置属于原电池的是 ; 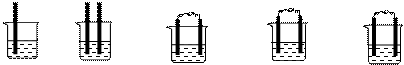
ZnZnCu Zn Cu Cu Cu Fe Cu
稀硫酸稀硫酸酒精稀硫酸稀硫酸
①②③④⑤
(2)在选出的原电池中,______ 是负极,发生______ 反应 ,______ 是正极 ,该极的现象___________________________;
(3)此原电池反应的化学方程式为___________________________。
氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
请回答:
(1)装置F中发生反应的离子方程式是;
(2)装置D中盛放的试剂是,其作用是;
(3)装置C中有白烟产生,试写出反应的化学方程式;
(4)若从装置C的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有的洗气瓶。
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
(1)写出下列物质的化学式;乙;B。
(2)写出③反应的化学方程式:。
(3)写出②反应的离子方程式:。
软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线可以是: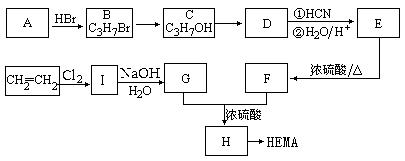
已知:① 
② CH3COOCH2CH2OH的名称为乙酸羟乙酯。
试写出:
(1)A、E的结构简式分别为:A、E。
(2)写出下列反应的反应类型:C→D,E→F。
(3)写出下列转化的化学方程式:
I→G;
G+F→H。