X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)X的最高价氧化物固态时俗称“ ”,属于 晶体。该分子的空间构型是 。
(2)Y的价层电子(外围电子)排布式为 ,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(3)XY2是一种常用的溶剂,XY2的分子 中存在 个σ键,属于 (填“极性”或“非极性
中存在 个σ键,属于 (填“极性”或“非极性 ”分子。
”分子。
(4)在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(5)W的基态原子核外电子排布式是 。在W的二价硫酸盐溶液中通入过量的氨气,小心蒸发,最终得到的[W(NH3 )4]SO4晶体中含有的化学键除了极性共价键外,还有 和 。
)4]SO4晶体中含有的化学键除了极性共价键外,还有 和 。
(6分)按下图装置实验,A、B两烧杯分别盛放200 g 10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极.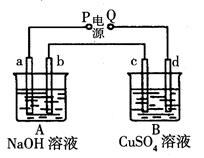
(1)标准状况下,b极产生气体的体积为__________L。
(2)c极上析出固体的质量为____________g。
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2 CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L—1) |
初始H2浓度(mol·L—1) |
CCl4的平衡转化率 |
| 1 |
110 |
1 |
1.2 |
A |
| 2 |
110 |
1 |
1 |
50% |
| 3 |
100 |
1 |
1 |
B |
(1)此反应在110℃时平衡常数为。
(2)实验l中,CCl4的转化率A50%(填“大于”、“小于”或“等于”)。
(3)实验3中,B的值(选填序号)。
A.等于50%B.大于50%
C.小于50% D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是 ________(选填序号)。
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1 ;平衡常数为K1 ;
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g)ΔH=+1160 kJ·mol-1 ;平衡常数为K2 。
请回答下列问题:
(1)反应CH4 +2NO2 N2+CO2+2H2O(g) 的平衡常数K=(用K1、K2表示)。
N2+CO2+2H2O(g) 的平衡常数K=(用K1、K2表示)。
(2)若用标准状况下4.48LCH4还原NO2至N2 ,整个过程中转移的电子总数为(阿伏伽德罗常数用NA表示),放出的热量为kJ。
下图烧杯中都盛有稀硫酸,则:
(1)A中进行的离子反应方程式为。
(2)B中负极反应式:;溶液的pH___________(填入增大、减小或不变)。
(3)C中被腐蚀的金属是,正极反应式为。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是。
(5)某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是()
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则甲烷燃烧的热化学方程式为。
(2)科研人员新近开发出一种由甲醇(CH3OH)和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:
A、甲醇在(正或负)极上发生反应,电极反应式为。
B、电池反应的离子方程式:。