短周期元素在元素中占有重要地位。X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
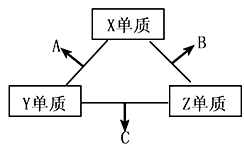
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是________周期____________族 。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在_____________ 。
(3)在C分子中,Y原子的杂化方式为 ,与Y原子同主族在第四周期的元素原子基态电子排布式是 。
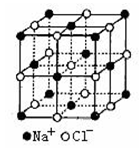
(4)NaCl的晶体结构如右上图所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构。则该X的氧化物的化学式为 。
有H+浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同
时加入足量的锌,则开始时反应速率由大到小的顺序是(用
a、b、c表示), 完全反应后生成H2的体积由大到小是 。
某化学研究性学习小组探讨Fe3+和 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为____________________________________。
乙同学认为发生双水解反应,其反应方程式为2Fe3++3 +6H2O===2Fe(OH)3(胶体)+3H2SO3。
+6H2O===2Fe(OH)3(胶体)+3H2SO3。
……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是________。
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:____________________________。
②实验③中溶液变成血红色的有关离子方程式为_____________。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是__________________________。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除 水解能力较
水解能力较 小外,还有________。
小外,还有________。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式,该反应的熵变⊿S0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表: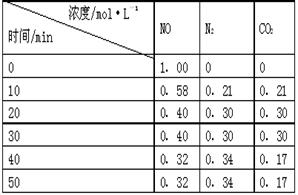
①10min~20min以V(CO2) 表示的反应速率为 。
②该反应的平衡常数的表达式为:K=,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③下列各项能作为判断该反应达到平衡的是(填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率(填“增大”、“不变”或“减小”) 。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。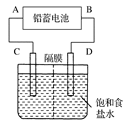
已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+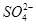 -2e-===PbSO4
-2e-===PbSO4
正极 PbO2+4H++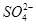 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。