(13分)钠、铝、铁、铜等金属及其化合物在社会生活的各个领域均有重要的应用。回答下列问题:
(1)常温下将一定量的氯气通入石灰乳中,可制得漂白粉,其有效成分的化学式为___________;电解熔融态NaCl可以制得金属钠,反应的化学方程式为_____________________。
(2)Au、Cu、Fe三种块状金属中,常温下能够全部溶于足量浓硝酸的是___________; Mg(OH)2、Al(OH)3、AgOH三种氢氧化物中,能溶于氨水的是______;硬铝是由Al、Cu、Mg、Si组成的铝合金,将硬铝废料投入氢氧化钠溶液中充分反应,溶液中含有的含氧酸根离子有___________。其中铝发生反应的离子方程式为______________。
(3)FeCl3溶液可以吸收烟气中的SO2,所得溶液能与软锰矿(主要成分为MnO2)反应生成硫酸锰(MnSO4),该反应的离子方程式为_______________。
(4)等浓度的Na2CO3、H2SO4、Ba(OH)2三种溶液,若以不同顺序将体积相等的三种溶液中的两种混合,若有沉淀先过滤,再将混合液与第三种溶液混合,最终所得的溶液不可能呈________(填“酸性”、“碱性”或“中性”)。
(选考)【化学—选修2:化学与技术】
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的极(填“正”或“负”),负极反应式为;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
① 生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是。
② 下列有关说法正确的是(填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式。
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
①600K时,Y点甲醇的υ(逆)(正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)=;
实验温度T1T2(填“>”、“<”);催化剂的催化效率:实验①实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,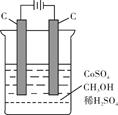
则Co2+在阳极的电极反应式为;除去甲醇的离子方程为。
X、Y、Z、W四种常见元素,且均为短周期元素。已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为。
(2)Z的氧化物在通信领域用来作,工业上制Z单质的化学反应方程式为。
(3)在50mL lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列实验方案进行探究。称量x g Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
欲计算W的质量分数。该实验中还需测定的数据是。若用空气代替O2进行实验,对测定结果是否有影响?若有影响分析其原因。
二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2②2MnO+O2
MnO+CO2②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰热分解反应的平衡常数表达式K=(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为。
(2)反应②在低温下能自发进行,则其△H0(填“>”、“<”、“=”)。
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制备反应合适的焙烧温度为,合适的含水量气氛条件为。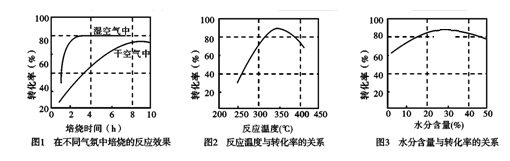
(4)MnO2也可在MnSO4—H2SO4—H2O为体系的电解液中电解获得,其阳极的电极反应式为,电解后溶液的pH将(填“增大”、“ 减小”或“不变”)。
已知某溶液中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:
①取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;
②将沉淀过滤、洗涤、灼烧,得到1.6 g固体;
③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。
请回答下列问题:
(1)结合①和②,判断原溶液中肯定含有的离子是,可以排除的离子是。
(2)由③推知原溶液中一定有离子,其物质的量为mol。
(3)综合(1)、(2)及题干信息,结合溶液中电荷守恒知识,还可以排除的离子是。该学习小组最终得出结论:该溶液由种阳离子(填数字,下同)和种阴离子组成。