近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: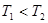 )
)
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
N2(g)+O2(g)为(填“吸热”或“放热) 反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)两套装置中的A、B处都需加热,
A处用水浴加热,B处用▲加热,A处用水浴加热的主要优点是▲。
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是▲,
B中反应的化学方程式为▲。
(3)若按乙装置进行实验,则B管中应装▲,B中反应的化学方程式为▲。
(4)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是▲。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为▲。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为▲。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团▲。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有▲种氢原子。 综上所述,A的结构简式为▲ |
下列说法正确的是▲(填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
②水的沸点是100℃,酒精的沸点是78.5℃,用直接蒸馏法能使含水酒精变为无水酒精
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离
④分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100 nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出
⑥不慎把苯酚溶液沾到皮肤上,应立即用酒精洗涤
⑦用稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚
⑧实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃
(15分) 化合物A(分子式为C9H9O2Br)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。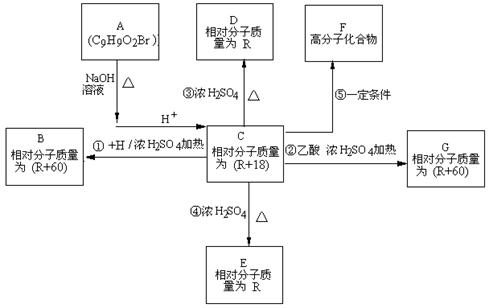
(1)写出A含有官能团的名称:;
(2)H可能是(写名称):__________________________________________________;
(3)写出反②、③的反应类型:②__________________、③__________________;
(4)写出E、G的结构简式EG;
(5)反应⑤的化学方程式:
(6)同时满足下列条件的C的同分异构体有_________ 种:
①能发生银镜反应;
②1mol该物质可以消耗3molNaOH;
③苯环上的一氯代物有3种。
(10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。