(10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为。
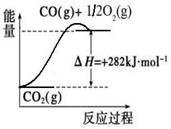
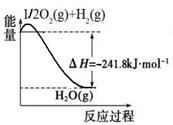
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g) [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)△H<0
CO(NH2)2(l)+H2O(g)△H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.30×10-7Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈性(填“酸”、“中”、“碱”),原因是。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
CO2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。

(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H2CO3、HCO3-、OH-、H+四种微粒浓度由大到小关系为:。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是 。
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为,C的电子式。
(2)写出SCl2和气体C反应的化学方程式。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式。
(4)亚硝酸钠和D固体在加热条件下(填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案。
【化学-选修3物质结构与性质】
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为.
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是.简述你的判断依据.
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于(选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为。
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为.
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是.铁原子的配位数是,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为(设阿伏加德罗常数的值为NA)。 、
、
【化学-选修2化学与技术】
如图是现今常规生产发烟硫酸和硫酸的流程图:
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是.该处发生反应的方程式为.为提高三氧化硫的产率,该处应采用(填“等温过程”或“绝热过程”)为宜.
(2)在⑦处进行二次催化处理的原因是.
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为:.
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水吨(保留2位有效数字)才能配制成98%的成品硫酸.
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 .