某反应物A的浓度是2.0mol/L , 5min后,A的浓度变为0.5mol/L ,在这5min内A的化学反应速率是
| A.0.4 mol·L-1·min-1 | B.0.3 mol·L-1·min-1 |
| C.0.1 mol·L-1·min-1 | D.0.3mol/L |
25 ℃在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×109 |
| C.1∶20∶1010∶109 | D.1∶10 ∶104∶109 |
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
A.平衡常数K = 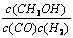 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.任意时刻,T2温度下的反应速率均大于T1温度下的速率 |
D.处于A点的反应体系从T1变到T2,达到平衡时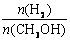 增大 增大 |
室温下,对于0.10 mol·L—1的氨水,下列判断正确的是
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
下列说法正确的是
| A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 |
| B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 |
| C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 |
| D.铜、石墨均导电,所以它们是电解质 |