(11分)现有A、B、C、D、E、F六种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
一种核素的原子核内不含中子 |
| B |
原子核外电子有6种不同运动状态 |
| C |
最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D |
单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E |
周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| F |
该元素的一种氧化物M可用作油漆颜料,与某单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
(1)画出元素C的基态价电子排布图: ;F元素位于周期表的__ 区;B、C、D三种元素的第一电离能由大到小顺序为: (用元素符号表示)。
(2)化合物BA2D2蒸气293 K时,理论测算密度为2.0g·L-1,实际密度为2.5 g·L-1的原因是 。
(3)ED2中F原子的杂化类型为 ; ED2易溶于水的原因可能是: (填入序号)。
①ED2与水极性相同
②ED2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为: 。
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式; 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是。
| A.Ag | B.Cu | C.Al | D.Fe |
(4)烧碱、纯碱均可吸收CO2,当含0.2 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
①;②Na2CO3;③;④NaHCO3
将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,再将溶液蒸干,得到固体的质量是g。
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.
试推断:
(1)写出物质的化学式:A:____________、C:____________、I:____________.
(2)写出下列反应的方程式:
C→F的离子方程式______________________________________________.
H→I的化学方程式________________________________________________.
(8分).某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。试验流程如下:
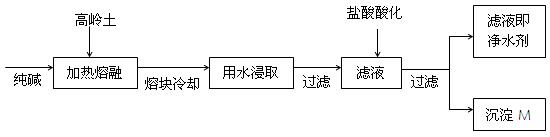
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似。用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式、
。
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器(填写编号)
| A.铁坩埚 | B.瓷坩埚 | C.氧化铝坩埚 | D.玻璃坩埚 |
(3)写出上述过程中,最后得到的沉淀M的化学式。
(8分)有X、Y、Z、W四种在中学学过的固体化合物,实验现象如下:
①X、Y、Z、W的焰色反应均为黄色。
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出。
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解。
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现。其中W溶液中气泡出现较快。
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成。
根据上述现象,回答下列问题:
(1)X的化学式为,Y的化学式为;
(2)写出下列有关反应的化学方程式或离子方程式。
①Z+石灰水(离子方程式);
②X+ CO2(化学方程式);
③W (化学方程式)
(化学方程式)
 。
。
(1)2008年北京奥运会奖牌用玉,其主要化学成分为Ca2Mg5Si8O22(OH)2. 把它写成氧化物的形式为
(2)漂白粉长期露置在空气中会失效的反应的化学方程式为;
;
(3).防治碘缺乏病的碘添加剂是KIO3(如加碘盐) ,可用盐酸酸化的KI淀粉混合液检验食盐是否加碘,其反应的离子方程式为:
,可用盐酸酸化的KI淀粉混合液检验食盐是否加碘,其反应的离子方程式为:
(4)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。试写出(CN)2与KOH溶液反应的化学方程式 : __________________________________________。
: __________________________________________。