实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。
(1)按气体流向由左到右排列,各装置的连接顺序为(填写A—E序号): 。
。
(2)装置连接好后,应该首先进行的实验操作是 。
(3)A装置烧瓶中反应的离子方程式是_________________________。
(4)E中盛装的试剂是____________,其作用是 。
(5)停止反应后,还有铁丝剩余。为检验FeCl3生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解, ① 除去不溶物;
b.取少量滤液,滴加 ② 溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
①采取的操作方法是 ;②中所加试剂为 。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式) 。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液。
| A.KMnO4(H+) |
| B.Fe |
| C.H2O2 |
| D.Cl2 |
E.HNO3
F.盐酸
G.O3
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下: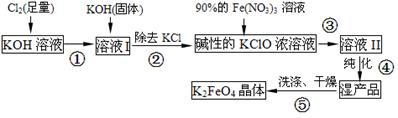
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
| A.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使副产物KClO3转化为 KClO |
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液Ⅱ中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。
硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不
溶于乙醇。工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
(1)为了加快软锰矿与硫酸、黄铁矿反应的速率,工业上除采用粉碎软锰矿的方法,还可以用哪些方法 (写两种)。
(2)流程中黄铁矿(主要含FeS2)和FeSO4的作用都是作还原剂,请写出FeSO4与软锰矿反应的离子方程式 。
(3)双氧水和氨水的作用分别是 .
(4)操作II包括 、 、 、洗涤、干燥,可制得MnSO4·H2 O粗产品.洗涤中最好选用
| A.稀硫酸 | B.水 | C.乙醇 | D.浓硫酸 |
铝热反应是铝的一个重要性质。某校化学兴趣小组同学为了克服传统铝热反应纸漏
斗易燃烧,火星四射等缺点,将实验改成以下装置,取磁性氧化铁在如图A实验进行铝热反应,冷却后得到“铁块”混合物.
(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,共原因是 。
(2)该铝热反应的化学方程式为 。
(3)取反应后的“铁块”研碎取样称量,加入如图B装置,滴入足量NaOH溶液充分反应,测量生成气体体积以测量样品中残留铝的百分含量.试回答下列问题:
①量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为
②量气管在读数时必须进行的步骤是 。
③取1g样品进行上述实验,共收集到44.8mL气体(换算成标准状况下),则铝的百分含量为 。
④装置中分液漏斗上端和试管用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用。如果装置没有橡胶管,测出铝的百分含量将会 填“偏大”或“偏小”)。
铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH ="=" 2Na2FeO4 + 3X + 5H2O, 则X的化学式 ,反应中被氧化的物质是 (写化学式)。
(2)铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: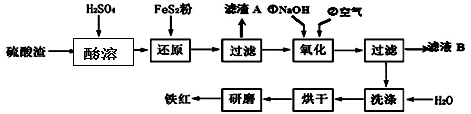
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为____ ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2 + Fe3 + + H2O ="=" Fe2 + + SO42- + ___ 。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 _______。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
如果pH过大,可能引起的后果是 __ (几种离子沉淀的pH见上表);滤液B可以回收的物质有(写化学式) 。
在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出1.12L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为3.6g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在 ,若存在求其最小浓度,若不存在说明理由 。