金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。
请回答下列问题:
①试推测,在金属系列中,钛属于 (填“较活泼”或“较不活泼”)的金属。金属钛耐腐蚀可能原因是 。
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为 。
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化。有关氢氧化物开始沉淀的pH如表l
表l 有关氢氧化物开始沉淀的pH
| 氢氧化物 |
Ti(OH)4 |
Ti(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| pH |
0.5 |
3.0 |
1.5 |
7.6 |
某地钛铁矿的主要成分为FeTiO3,含有少量杂质Al2O3、SiO2,提纯TiO2并得到副产品绿矾(FeSO4·7H2O)的工艺流程如图l所示。
图1 工艺流程图
黑钛液中生成的主要阳离子有TiO2+、Fe2+,写出反应①主要的化学方程式: ;加入Fe的目的是 ;步骤④生成Ti(OH)4的离子方程式: 。
(3)钛冶炼的新法是电解法,图2是一种电解制钛的工艺(OS法)示意图。CaC12/CaO共熔体为质,在阴极,被还原的Ca进一步还原TiO2得到钛,写出阴极制得钛的有关反应方程式 。
(4)我国科学最新研发的技术——固体透氧膜提取金属钛(SOM)工艺(见图3):将钛氧化物(钛全看作Ti4+)矿熔于MCl—MF融盐体系(M为Na、K、Ca等),以石墨为阴极,阳极为覆盖氧渗透膜的多孔金属陶瓷涂层。固体透氧膜把阳极和熔融电解质隔开,只有氧离子可以通过,电解过程中阴极通入H2,则阳极电极反应式为 。
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用来酸化KMnO4溶液,褪色所需时间tAtB(填“>”、“=”或“<”)。
②写出该反应的离子方程式。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入(填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因:
。当____
,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 |
滴定前读数(mL) |
滴定后读数(mL) |
| 1 |
0.00 |
20.10 |
| 2 |
1.00 |
20.90 |
| 3 |
1.10 |
21.10 |
则消耗KMnO4溶液的平均体积为mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为。
④误差分析:下列操作会导致测定结果偏高的是。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下: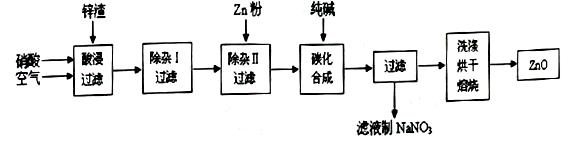
有关氢氧化物完全沉淀的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
6.7 |
8.0 |
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式。
(5)从滤液中提取NaNO3晶体的操作步骤为。
(6)在实验室如何洗涤过滤出的碱式碳酸锌?。
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
回答下列问题:
(1)检查装置E气密性的操作方法是。
(2)利用上述装置制取氢化钙时按气流方向连接顺序为i→___→___→___→→→→a(填仪器接口的字母编号)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;__________________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(4)写出CaH2与水反应的化学方程式_________________________________________ ;登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________。
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 |
预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 |
|
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 |
若品红褪色(或有气泡),则 |
| 步骤3: |
若 则; 否则 。 |
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题: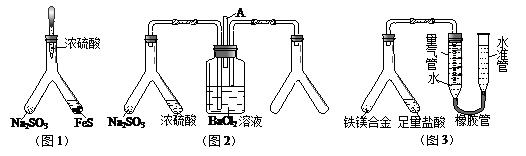
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为,硫化亚铁处加水的目的是。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是和 ,导气管A的作用是。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为(精确到0.01%)。