现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下: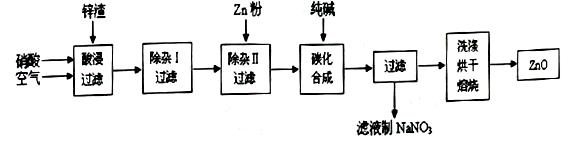
有关氢氧化物完全沉淀的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
6.7 |
8.0 |
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取 措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是 。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式 。
(5)从滤液中提取NaNO3晶体的操作步骤为 。
(6)在实验室如何洗涤过滤出的碱式碳酸锌? 。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、
NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: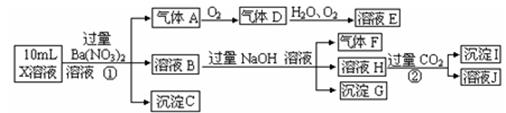
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子(Q)是_________,若要确定该Q(若不止一种,可任选一种)不存在,检验的最可靠的化学方法是_______________________。
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A_______________________。②_____________________________。
(4)假设测定A、F、I均为0.01mol, 10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题: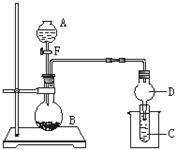
⑴图中D装置在实验中的作用是。
⑵若 A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程为。
⑶若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现是;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的离子反应方程式。
⑷若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是,C中发生反应的离子方程式为。
(5)若B为块状大理石,C为 溶液,实验中观察到溶液变浑浊,则酸A不宜用下列的________。
溶液,实验中观察到溶液变浑浊,则酸A不宜用下列的________。
| A.HCl | B.HNO3 | C.H2SO4 | D.CH3COOH |
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
(1)实验目的:测定铜粉样品中铜的质量分数
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)表1实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=______。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的 装置可以是_____________,其中盛放的药品是____________。
装置可以是_____________,其中盛放的药品是____________。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: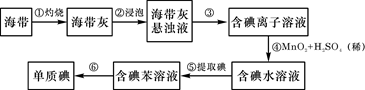
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)步骤④反应的离子方程式是。
(4)步骤⑤的实验操作名称是;某学生选择用苯来提取碘的理由是。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。
实验室里从海藻中提取碘的流程如下图: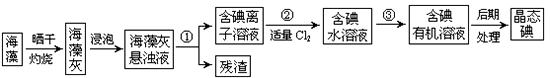
(1)指出提取碘的过程中有关的实验操作名称:①,③;
过程②中有关反应的离子方程式为。
(2)提取碘的过程中,可供选择的有机试剂是
| A.甲苯、酒精 | B. 四氯化碳、苯 四氯化碳、苯 |
C.汽油、乙酸 | D.汽油、甘油 |
(3)从含碘的有机溶液中提取碘和回收有 机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处:
机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处:
①;
②;
③。