利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题: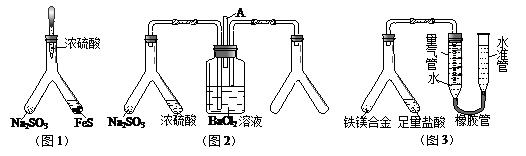
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
(1)操作②中所用的加热仪器应选(选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
| 1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为(填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在℃左右;
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择mol/L左右。
已知:苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。乙醚的沸点为34.6℃。实验室常用苯甲醛制备苯甲醇和苯甲酸,其原理为:2C6H5―CHO+NaOH C6H5―CH2OH+C6H5―COONa
C6H5―CH2OH+C6H5―COONa
实验步骤如下:
①向如图所示装置中加入适量 NaOH、水和苯甲醛,混匀、加热,使反应充分进行。
②从冷凝管下口加入冷水,混匀,冷却。倒入分液漏斗,用乙醚萃取、分液。水层保留待用。将乙醚层依次用10%碳酸钠溶液、水洗涤。
③将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇。
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体。冷却、抽滤得粗产品,将粗产品提纯得苯甲酸。
(1)步骤②中,最后用水洗涤的作用是。将分液漏斗中两层液体分离开的实验操作方法是:先后。
(2)步骤③中无水硫酸镁的作用是。
(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为;将反应后混合物冷却的目的是。
(4)抽滤装置所包含的仪器除减压系统外,还有、(填仪器名称)。
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:
已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×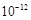
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。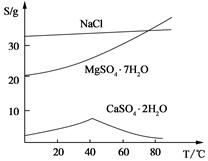
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约(MgSO4·7H2O式量为246)
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:
已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题: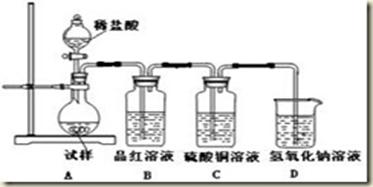
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为________________;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为__________;此时在B、C两装置中可能观察到的现象为___________或___________。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)为___________。检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取____________措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是______(填“甲”或“乙”)。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式____________。