废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
| 1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。
某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积 |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度:____________________________
现用98%的浓H2SO4(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:烧杯、量筒、玻璃棒、、
(2)请将下列操作按正确的顺序把序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.定容,最后用胶头滴管加水至刻度 |
| D.洗涤所用仪器并将洗涤液一并转入容量瓶 |
E.稀释浓H2SO4
F.冷却后将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓H2SO4的体积为mL。
②洗涤烧杯2~3次,洗液没有转入容量瓶,会使最终结果;定容时必须使溶液
凹液面最低处与 刻度相切,若俯视会使结果。(以上填“偏高”、“偏低”或“无
刻度相切,若俯视会使结果。(以上填“偏高”、“偏低”或“无
影响”)
下列说法中,正确的是____
| A.选用酒精作为萃取剂从碘水中萃取碘 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.在做蒸馏实验时,冷凝器中的水流方向应该与馏分的流动方向相反 |
| D.蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热 |
E.分液漏斗使用前不需要检查是否漏水,但需要用蒸馏水润洗2~3次
F.浓硫酸不慎沾在皮肤上,立即用稀氢氧化钠溶液冲洗
G.蒸馏操作时,应使温度计水银球插入蒸馏烧瓶中液面下,但不能接触瓶底
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
(1)分离饱和食盐水与沙子的混合物。______
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾。______
(3)分离水和汽油的混合物。___ ___
___
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。______
在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分。试回答以下问题: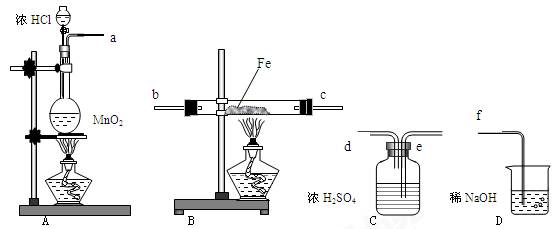
(1)实验时,各装置接口的连接顺序为(用a、b、c、d等字母表示);
(2)C装置的作用是;
(3)D装置的作用是;
(4)检验B装置中反应后铁是否有剩余的方法是:;
(5)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁,(答:是 或否);说明理由:。
或否);说明理由:。