下列说法中,正确的是____
| A.选用酒精作为萃取剂从碘水中萃取碘 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.在做蒸馏实验时,冷凝器中的水流方向应该与馏分的流动方向相反 |
| D.蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热 |
E.分液漏斗使用前不需要检查是否漏水,但需要用蒸馏水润洗2~3次
F.浓硫酸不慎沾在皮肤上,立即用稀氢氧化钠溶液冲洗
G.蒸馏操作时,应使温度计水银球插入蒸馏烧瓶中液面下,但不能接触瓶底
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体,以证明+6价S的氧化性强于+1价H。
(1)填写装置的作用: B, C,G。
(2)证明有SO2生成的现象是
(3)可以证明气体X中含有氢气的实验现象是:E中:__________________,F中:__________________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或 “不能”),原因是______
。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是,要确认CuSO4生成,待试管冷却后,。
钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过程如下:
已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、(填操作名称);步骤④在实验室中常将试剂置于(填仪器名称)中加强热。
(2)TiO2+生成H2TiO3的离子方程式
(3)步骤④中硫酸亚铁晶体(FeSO4·7H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式:
(4)步骤②所得到的硫酸亚铁晶体(FeSO4·7H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeO·FeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO4·7H2O的物质的量应为废水中六价铬物质的量的倍。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A到E为实验室常见的仪器装置(夹持装置略去),请根据要求回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接,接,接h;
(2)用下图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用(选填字母编号);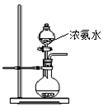
A碱石灰 B生石灰 C.无水氯化钙 D.无水硫酸铜 E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的
气体是,试写出制纳米级碳酸钙的化学方程式;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
。
某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题: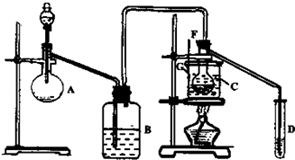
(1)实验开始时,仪器A中盛放电石,B中应装入_______,其作用是_________ 。
(2)仪器D中盛放水,其作用是__________________________________________ 。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称_______________________ 。
(4)所选用温度计G的量程表示正确的是________ 。
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.50℃~100℃ |
(5)检验乙醛已制出的操作、现象是______________________________________ 。
现有一块铁碳合金,某化学兴趣小组为了测定合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置进行实验(夹持仪器已省略),请你参与此项活动并回答相应的问题。
(1)以下有关合金的说法,正确的是(填写字母)
A.铁碳合金的熔点高于纯铁和碳
B.铁碳合金的熔点介于纯铁和碳之间
C.铁碳合金的硬度大于纯铁
D.其他条件相同时,铁碳合金的耐腐蚀性强于纯铁
(2)按图示连接好装置,检验气密性,加入药品,称量F的质量,将m g合金样品放入A中,再通过B加入过量的浓硫酸。未点燃酒精灯前,A中无明显现象,其原因是:。
(3)点燃酒精灯,反应一段时间后,C、D中可观察到明显的现象。写出合金样品在A中反应的化学方程式_______,_____________________________。
(4)C中的现象是_______________________,D中足量酸性KMnO4溶液的作用是。