在下列反应中,化学式下面画有短线的物质只作氧化剂的是
| A.2NH3+3Cl2====N2+6HCl |
B.2NH3+3CuO N2+3Cu+3H2O N2+3Cu+3H2O |
| C.Cl2+2NaOH====NaCl+NaClO+H2O |
| D.KClO3+6HCl(浓) ====KCl+3Cl2↑+3H2O |
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
| 时间/min |
c(H2)/mol·L-1 |
c(CH3OH)/mol·L-1 |
v(正)和v(逆)比较 |
| t0 |
6 |
0 |
? |
| t1 |
3 |
1 |
v(正)=v(逆) |
A.t0~t1时间内v(H2)=3/(t1-t0) mol·L-1·min-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T ℃时,平衡常数K=1/27,CO2与H2的转化率相等
一定温度下,在某2 L恒容密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)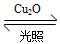 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.001 0 |
0.001 6 |
0.002 0 |
0.002 0 |
下列说法正确的是( )
A.达到平衡时,需要从外界吸收的能量为0.968 kJ
B.前20 min内的平均反应速率v(H2O)=2.5×10-5mol·L-1·min-1
C.增大c(H2O),可以提高水的分解率
D.使用颗粒更小的纳米级Cu2O,可以增大平衡时O2的体积分数
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
| A.提高尾气净化效率的最佳途径是研制高效催化剂 |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下:
①CH4(g)+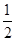 O2(g)
O2(g) CO(g)+2H2(g) ΔH<0
CO(g)+2H2(g) ΔH<0
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
下列说法不正确的是( )
| A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态 |
| B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 |
| C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率 |
| D.同一容器内同时发生反应①与②时,容器内温度可能保持不变 |