钢铁发生腐蚀时,正极上发生的反应是
| A.2Fe-4e- = 2Fe2+ | B.2Fe2++4e- = 2Fe |
| C.2H2O+O2+4e-= 4OH- | D.Fe3++e-= Fe2+ |
下列各种烃与氢气完全加成后,能生成2,3,3-三甲基戊烷的是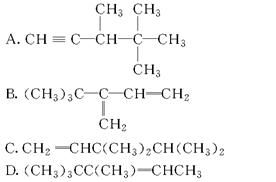
下列化学用语正确的是
A.乙酸根离子的结构式: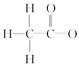 |
B.CO2分子的球棍模型: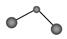 |
| C.3甲基1丁烯的结构简式:(CH3)2CHCH=CH2 |
D.醛基的电子式为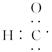 |
【改编】下列有关有机化合物的说法正确的是
| A.用水可以区分乙酸乙酯和苯 |
| B.有机物分子中都存在碳碳单键 |
| C.聚乙烯不可以使溴水褪色 |
| D.乙醇、油脂、淀粉是人们必需的营养物 |
下列对有机化合物的分类结果正确的是
| A.乙烯CH2===CH2、苯、环己烷都属于脂肪烃 |
B.苯、环戊烷 、环己烷同属于芳香烃 、环己烷同属于芳香烃 |
| C.乙烯CH2===CH2、乙炔CHCH同属于烯烃 |
D. 同属于环烷烃 同属于环烷烃 |
【改编】一种兴奋剂X的结构如图所示.下列说法的错误是
| A.一定条件下,1mol X与足量NaOH溶液反应,最多可消耗5mol NaOH |
| B.1mol X与足量浓溴水反应,最多消耗4mol Br2 |
| C.X遇FeCl3溶液显紫色 |
| D.分子中不含氧的官能团有3种 |