常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
| A.硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH约为13 |
| D.溶液的导电能力:c<d=b<a |
下列有关叙述中正确的是:( )
A 难溶于水的电解质一定是弱电解质
B 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C 易溶于水的电解质一定是强电解质
D 强电解质在水溶液中的电离过程是不可逆的
(深圳新安中学2008-2009学年第一学期期末)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是:
| A.在冰醋酸中这四种酸都没有完全电离 |
| B.在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42- |
| D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱 |
下列电离方程式书写正确的是
| A.NaHCO3 = Na++ H+ +CO32- | B.H2S 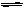 2H+ + S2- 2H+ + S2- |
C.Na2HPO4 = 2Na+ + HPO42- HPO42-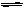 H+ + PO43- H+ + PO43- |
|
D.2 H2O 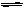 H3O+ + OH- H3O+ + OH- |
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用的方法是()
| A.加热 | B.加入0.1mol/L 的醋酸溶液100mL |
| C.加入少量的0.5mol/L的硫酸 | D.加入少量的1mol/L 的NaOH溶液 |
下列各组物质中都属于弱电解质的一组物质是( )
A. NH3、SO2、H2O、HI B.HF、H2O、NH3•H2O、H2SO3
C. BaSO4、Cl2、HClO、H2SD.NaHSO3、H2O、CO2、H2CO3