"鱼浮灵"主要成分是过碳酸钠(
).俗称固体双氧水.某兴趣小组对其进行以下探究:
【实验探究一】过碳酸钠的性质探究
(1)取少量"鱼浮灵"于试管中,加适量的水,有持续细小气泡缓慢放出;向试管中加入少量
粉末,产生大量气泡.将带火星的木条伸入试管,木条复燃,说明有
(2)取实验(1)中上层清液,测得溶液
;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清的石灰水中,出现浑浊现象,说明有二氧化碳生成.写出二氧化碳与澄清石灰水反应的化学方程式
结论:过碳酸钠具有
和双氧水的双重化学性质.
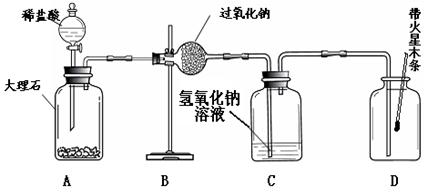
【实验探究二】"鱼浮灵"样品的组成测定
利用如图所示装置进行"鱼浮灵"样品中活性氧含量测定和过碳酸钠(
)组成的测定(杂质对测定无影响)。
查阅资料:
①活性氧含量是指样品中能转化为氧气的氧元素的质量分数."鱼浮灵"中活性氧含量
是一等品,
活性氧含量
是合格品.
②过碳酸钠能与酸反应放出二氧化碳和氧气.

(3)实验前先缓慢通入
一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至
中样品完全反应;继续缓慢通
.实验前先缓慢通入
一段时间的目的是
(4)装置
的作用
除去气体中水蒸气
便于观察和控制气流速度
(5)若没有装置
,会导致
的值
(6)实验测得
装置中铜网增重
,D装置增重
.该产品中活性氧含量为
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动。
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,溶于水并能与水反应,“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”
【猜想与探究】
猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物
【实验与结论】
| 实验操作 |
实验现象 |
实验结论 |
|
| 猜想 |
在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,充分振荡 |
猜想a、c不成立,猜想b成立。 |
【提出问题】过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
【提出猜想】过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
【进行实验】
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气。
王轩同学设计如下图所示装置:
(1)实验现象及结论:观察到____________现象,判断过氧化钠与氮气没有发生反应。
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
华宇同学设计了如下图所示装置
(2)其中A装置的作用是____________。
(3)实验现象及结论:带火星的木条复燃。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。李杰在老师的指导下也设计了如下图所示装置。(不考虑稀盐酸的挥发)
| 实验操作 |
主要实验现象 |
实验结论及解释 |
|
| ① |
检查装置的气密性。 向装置中加入药品。 |
装置的气密性良好。 |
|
| ② |
打开分液漏斗活塞,向A装置中缓慢加入稀盐酸。 |
A装置中观察到的现象有__________, C装置中有气泡出现。 |
A装置中发生反应的化学方程式为________; |
| ③ |
一段时间后用带火星的木条在D内进行检验。 |
带火星的木条复燃。 |
过氧化钠与二氧化碳反应并生成氧气。 |
(4)实验记录
【实验反思】
张红同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是________。请你回答如何改进该实验。
通常情况下,人体呼出气体中部分气体的含量和空气中部分气体的含量有所不同。请你根据所学的知识,完成下列实验报告。
| 操作步骤 |
现象 |
结论 |
| 取呼出气体和等体积的空气各一瓶,将燃着的小木条分别插入集气瓶中,盖上玻璃片 |
人体呼出气体中氧气的含量小于空气中氧气的含量 |
|
| 取呼出气体和等体积的空气各一瓶,向其中各滴入相同滴数的澄清石灰水 |
呼出气体瓶中澄清石灰水变浑浊,空气瓶中无明显现象 |
|
| 被哈气的干燥玻璃片上有水珠,未被哈气的干燥玻璃片上没有明显现象 |
人体呼出气体中水蒸气的含量高于空气中水蒸气的含量 |
学校化学探究小组用HCl与大理石反应研究影响反应剧烈程度的因素。实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10 g;所用HCl溶液的质量分数为9.125%、18.25%,每次实验HCl溶液的用量为20mL(假设两种溶液密度均为1 g/㎝3;大理石中杂质不与盐酸反应)。
【提出问题】:影响HCl与大理石反应的剧烈程度的因素有哪些?
【做出猜想】:
猜想一:大理石规格;猜想二:所用HCl溶液的质量分数;猜想三:。
【实验探究】:完成以下实验设计方案并实验。
| 实验 编号 |
T/℃ |
大理石 规格 |
HCl的 质量分数 |
完全反应 的时间/s |
实验目的 |
| ① |
25 |
粗颗粒 |
18.25% |
160 |
(I)实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响。 (II)实验①和③探究温度对该反应剧烈程度的影响。 (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响。 |
| ② |
210 |
||||
| ③ |
35 |
粗颗粒 |
18.25% |
60 |
|
| ④ |
100 |
【得出结论】:。
目前市场上销售的饮料大多数都是碳酸饮料,其中溶有大量的二氧化碳气体,请你用学过的知识验证打开汽水瓶盖时冒出的气泡中含有二氧化碳。将实验设计及相关内容填入下表中:
| 实验过程 |
实验现象 |
实验结论 |
某同学欲探究市售 “双钙防蛀”牙膏、“皓清”牙膏和牙粉的主要成分。
【查阅资料】
(1)牙膏和牙粉均是由摩擦剂、活性剂、香料等成分构成。
(2)常用的摩擦剂有极细颗粒的碳酸钙(CaCO3) 和水合硅酸(SiO2·nH2O)等
(3)牙膏和牙粉中除了碳酸钙以外,其它物质均不与稀盐酸反应产生气体。
【实验一】探究“两种牙膏和牙粉中是否都含有碳酸钙?
| 步骤 |
实验操作 |
实验现象 |
| ① |
 如图所示,取三只试管分别加入适量待测样品,再分别加入适量R 溶液。R 溶液是。 |
A试管中无明显变化, B和C试管中有无色气体生成。 |
| ② |
将B和C试管中生成的无色气体通入澄清石灰水。 |
现象Ⅱ:。 |
实验结论: 。
【实验二】比较样品中碳酸钙的含量
| 步骤 |
实验操作 |
实验现象 |
| ① |
组装两套如图装置进行实验。分别取 (操作Ⅰ),放于锥形瓶中。并在分液漏斗中分别加入等质量的R 溶液。  |
|
| ② |
打开分液漏斗注入一定量R 溶液,然后关闭活塞。 |
有气泡产生。 |
| ③ |
待②反应结束后,再打开分液漏斗,注入一定量R 溶液,然后关闭活塞。 |
无明显现象 |
| ④ |
称量反应后装置及药品的总质量并加以比较 |
加入“双钙防蛀”牙膏的装置及药品的总质量大于加入牙粉的装置及药品的总质量 |
实验结论:_____________________________________________________
步骤③的作用是:。
【反思】
(1)若不改动原有装置和基本步骤,要测定牙粉中碳酸钙的质量分数,还应测定的数据有:_______________________________________________________________
(2)小明认为该实验前不需要测定装置的气密性,请你说明其原因。