金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫。反应为:2CO(g)+SO2(g) 2CO2(g)+S(l)△H=-270kJ∙mol-1
2CO2(g)+S(l)△H=-270kJ∙mol-1
其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择 为该反应的催化剂较为合理。(选填序号)
a.Cr2O3 b.NiO c.Fe2O3
选择该催化剂的理由是: 。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图2)。则图2中表示n(CO) : n(SO2)=3:1的变化曲线为 。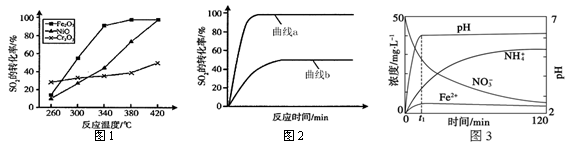
(2)科研小组研究利用铁屑除去地下水中NO3-的反应原理。
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图3(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前发生反应的离子方程式 ;t1时刻后,反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有明显变化,可能的原因是 。
②若在①的反应中加入活性炭,可以提高除去NO3-的效果,其原因可能是 。正常地下水中含有CO32-,会影响效果,其原因有:a.生成FeCO3沉淀覆盖在反应物的表面,阻止了反应的进行;b. 。
(3)LiFePO4电池具有稳定性高、安全、环保等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时电池正极反应为 。
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时电池正极反应为 。
分黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下: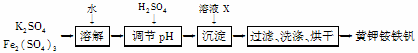
(1)溶液X是___________________。
(2)检验滤液中是否存在K+的操作是___________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
分工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: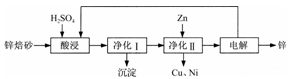
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
(4)本流程中可以循环利用的物质除锌外还有________________。
次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A。经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A中各元素的原子个数相等;A的主要化学性质如下:
①温度超过60℃,分解成金属铜和一种气体;
②在氯气中着火;
③与盐酸反应放出气体。
(1)A的化学式为
(2)A的生成反应方程式为
氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
(1)净化N2和H2时,铜屑的作用是:_________________;硅胶的作用是 。
(2)在氮化炉中3Si(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)
(4)如何说明氮化硅产品已用水洗干净? 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为 ;
②膦(PH3)能和水发生微弱的化学反应,其水溶液呈弱碱性,该反应可用离子方程式表示为 。
(2)生活污水中含大量细小的悬浮物,可加某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。
(3)用CH4催化还原NOX可以消除氮氧化物的污染。例如
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) △H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2= 。