在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇋2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
A、B、C三种元素的原子具有相同的电子层数,且都是短周期元素。已知A是一种金属元素,A原子的最外层电子数为1,它跟酸反应后转化成的A+具有跟Ne相同的电子层结构。B的质子数比A多2个,C的质子数比B多4个。根据以上条件,填空回答:
(1)C是元素(写元素名称),画出C原子结构示意图:。
(2)B元素在周期表中的位置是第周期,第族。
(3)C元素的气态氢化物的水溶液呈(填“酸性”、“碱性”、“中性”)。
(4)A与C形成的化合物的电子式:。
(5)B元素的最高价氧化物对应的水化物与C元素的气态氢化物的水溶液之间发生的化学反应方程式:。
Ⅰ.现有6种有机物:①乙烯 ②苯 ③乙醇 ④乙醛 ⑤乙酸 ⑥乙酸乙酯。按下列要求填写下列空格(填写序号):
(1)具有酸的通性的是;
(2)在一定条件下,能发生银镜反应的是;
(3)在一定条件下,既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,还能发生加聚反应的是;
(4)在一定条件下,既可发生加成反应,又可发生取代反应的烃是;
(5)在一定条件下,能发生水解反应的是。
Ⅱ.A是石油化工的原料,D是食醋的主要成分,E是具有果香味的液体。在一定条件下,它们的衍变关系如下:
(1)试写出A、B、C的结构简式:
A,B,C。
(2)写出B→C的化学反应方程式:。
一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:

则该反应的△H0(选填“>” 或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ.mol-1
CO2(g)+C(s)=2CO(g) △H2=+172.5kJ.mol-1
S(s)+O2(g)=SO2(g) △H3=-296.0kJ.mol-1
请写出CO除SO2的热化学方程式。 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为,H2的平均生成速率为。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为,H2的平均生成速率为。
(4)下图中图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。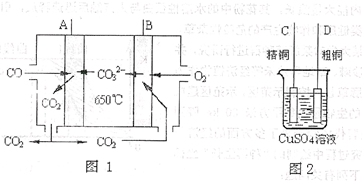
回答下列问题:
①写出A极发生的电极反应式。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为。
I.由C、H、O三种元素组成的有机物R,R的相对分子质量122,其中含碳元素的质量分数为68.9%,含氧元素的质量分数为26.2%。R与NaHCO3溶液反应,生成的气体能使澄清石灰水变浑浊。则R的分子式是____________________。
II.M是生产某新型塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键等)。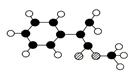
拟从芳香烃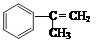 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
已知:M在酸性条件下水解生成有机物F和甲醇。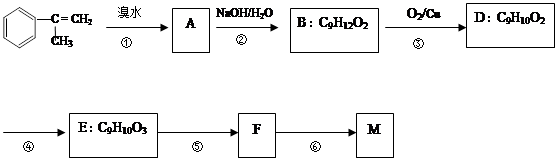
(1)M的结构简式。
(2)写出②、⑤反应类型分别为、。
(3)D中含氧官能团的名称为,E的结构简式。(4)写出反应⑥的化学方程式(注明必要的条件):
。
(5)写出符合下列两个条件的结构简式:①与F互为同分异构体;②能发生水解反应,水解产物有两种,一种能使溴的四氯化碳溶液褪色,另一种滴加FeCl3溶液显紫色。。
由两种元素组成的化合物A存在如下图所示的转化关系(部分产物及反应条件已略去)。已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质。L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G。试回答下列问题: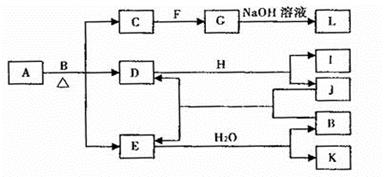
(1)物质K的名称是_________;I的晶体属于____________晶体。
(2)已知A中两种元素原子成最简整数比,且金属元素与非金属元素的质量比为14:1,则A的化学式为 。
(3)写出下列反应的化学方程式:
L露置于空气中时,由白色最终转化为红褐色____________。
A与B反应的化学方程式___________。
(4)H在D中燃烧的现象为____________。
(5)若各步反应都看成是进行完全的,则当生成a mol物质L时,需要A_________mol。