下列说法中正确的是
| A.KOH中含有离子键也含有共价键,属于离子化合物 |
| B.HCl中存在离子键,属于离子化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
V2O3和V2O5按不同物质的量之比混合可按计量比完全反应,今欲制备V8O17,则V2O3和V2O5物质的量之比为( )
| A.1∶2 | B.2∶1 | C.3∶5 | D.5∶3 |
如图横坐标表示完全燃烧时耗用可燃性气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气体,则C中n(A)∶n(B)为…( )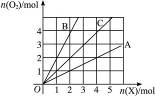
A.2∶1 B.1∶2 C.1∶1D.任意比
11P+15CuSO4+24H2O====5Cu3P+6H3PO4+15H2SO4反应中,1 mol Cu2+能氧化P的物质的量是( )
| A.2/5 mol | B.11/5 mol | C.1/5 mol | D.1/3 mol |
某含氧酸的钾盐(正盐),其化学式中有a个氧原子,所含另一种+6价元素R的原子数为b,则0.5 mol该盐中K+的物质的量是( )
| A.(a-b) mol | B.(2a-b) mol | C.(6a-b) mol | D.(a-3b) mol |
等质量的Fe分别与氧气反应生成FeO、Fe2O3、Fe3O4,所需氧气的物质的量之比是( )
| A.1∶3∶4 | B.6∶9∶8 | C.2∶3∶4 | D.3∶8∶9 |