下列生产或实验事实引出的相应结论不正确的是
| |
事实 |
结论 |
| A |
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 |
当其他条件不变时,升高反应温度,化学反应速率加快 |
| B |
工业合成氨中,将氨气液化分离 |
可以加快反应速率,提高N2、H2的转化率 |
| C |
FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体 溶液颜色加深 Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体 溶液颜色加深 |
恒温时增大反应物浓度,平衡向正反应方向移动 |
| D |
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 |
当其他条件不变时,催化剂可以改变化学反应速率 |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是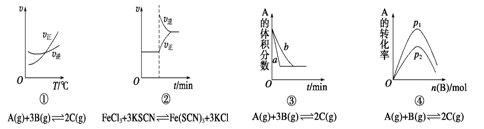
| A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在下建立的平衡过程图象,曲线a是使用催化剂的曲线 |
| D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是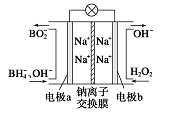
| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗3 mol H2O2,转移的电子为3 mol |
| C.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
D.该电池的负极反应为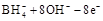  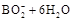 |
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是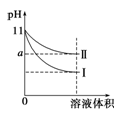
| A.a的数值一定大于9 |
| B.Ⅱ为氨水稀释时溶液的pH变化曲线 |
| C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
| D.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水) |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲,电解过程中的实验数据如图乙。横坐标表示转移电子的物质的量,纵坐标表示产生气体的总体积(标准状况)。则下列说法不正确的是
| A.电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
| B.b电极上发生的反应方程式为:4OH--4e- =2H2O+O2↑ |
| C.从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/ mol |
| D.从开始到P点收集到的气体是O2 |
现有室温下的四种溶液,其pH如下表所示,下列有关叙述不正确的是
| ① |
② |
③ |
④ |
|
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
NaOH溶液 |
醋酸 |
盐酸 |
A.③④中分别加入适量醋酸钠晶体,两溶液pH均增大
B.②③两溶液等体积混合,所得溶液中:c(OH-)>c(H+)
C.分别加水稀释10倍,溶液的pH:①>②>④>③
D.V1L④和V2L①溶液混合后,若pH=7,则V1<V2