SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知:① N2(g)+O2(g)= 2NO(g)ΔH=+180.6 kJ·mol-1
②C(s)+O2(g)= CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g)= CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2,要找到适合的物质G与适当的反应条件,G应为
(填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。NO2+G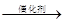 N2+H2O+nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是 (填写字母)。
N2+H2O+nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
(5)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
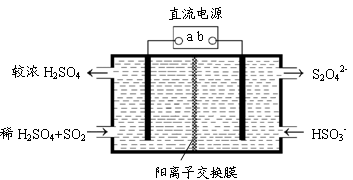
①b极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为 。
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略。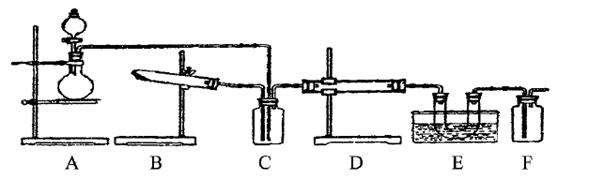
I.甲同学认为当D处盛放V2 O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现。
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是________________,C装置中盛放的液体药品的名称是________________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察________________得知。
(3)本实验在设计上有无缺失之处?若有请答出改进方案________________;(若无,此问可不答
II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅。
(4)写出乙同学认为的D装置中发生反应的化学方程式。
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理。
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基 本一致,那么C处的广口瓶应改为________________,所装药品为________________。
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。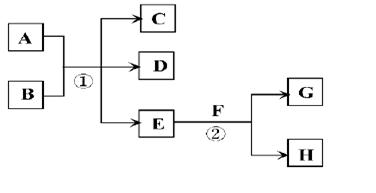
回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是________________。
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则反应①的离子方程式是________________。
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是________________。 (4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________________。
(4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________________。
(5)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是________________。
X、Y、Z、R、T是原子序数依次增大的短周期主族元素,X、R在周期表中的相对位置如右表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数;Z是地壳中含量最多的金属元素。
(1)X的最高价氧化物的电子式是_________,元素T在周期表中的位置是________________。
(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为________________。
(3)Y的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(4)已知由X和R形成的液态化合物XR2的燃烧热是1075 kj/mol,试写出表示其燃烧热的热化学方程式________________
I.“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合。综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:
| A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈); | B.溶解热效应实验(如硝酸铵溶于水); | C.装置的气密性检验实验; | D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等。 |
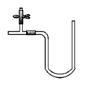
请从A或B中选择一项实验,画出该实验的装置图,写出实验名称。要求:①除U形气压计外,其他实验仪器或用品仅能从以下仪器中选取: 广口瓶、小试管、胶头滴管、橡皮塞、乳胶管、导管;②实验药品或试剂自定,但需在图中注明。
广口瓶、小试管、胶头滴管、橡皮塞、乳胶管、导管;②实验药品或试剂自定,但需在图中注明。
实验名称:
Ⅱ .广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的。
.广口瓶简单,但它的用途真不简单!实验室用Zn粒和盐酸反应制得的H2,其中含酸雾、水汽、硫化氢及少量氧气等杂质气体,某同学仅用四只广口瓶设计了以下几种装置,按一定顺序连接,便达到了当气体通过时,每一装置除去一种气体的目的。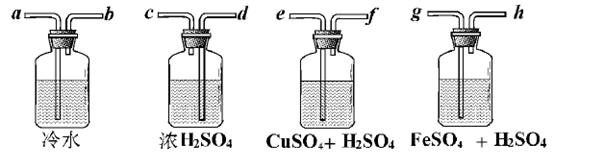
(1)它们连接的顺序为________________________________;
(2)除去H2S的离子方程式为________________;
(3)除去O 2的离子方程式为________________,观察到的现象为________________。
2的离子方程式为________________,观察到的现象为________________。
