下列鉴别方法不可行的是
| A.用水鉴别乙醇、甲苯和溴苯 |
| B.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| C.用燃烧法鉴别乙醇、苯和四氯化碳 |
| D.用酸性高锰酸钾溶液鉴别甲苯、环己烷和环己烯 |
某碱性蓄电池在充电和放电时发生的反应为:
Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
| A.放电时,负极上发生反应的物质是Fe |
| B.放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C.充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D.充电时,阳极附近pH值减小 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ·mol-1 |
| B.500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)  2NH3(g)△H=-38.6 kJ·mol-1 2NH3(g)△H=-38.6 kJ·mol-1 |
| C.HCl和NaOH反应的中和热△H="-57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ·mol-1 |
| D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1 |
下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述正确的是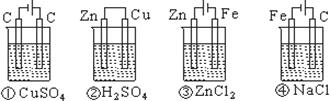
| A.工作一段时间后溶质的物质的量浓度①=②=③=④ |
| B.工作一段时间后溶液的pH:④>③=①>② |
| C.产生气体的总体积:④>②>①>③ |
| D.电极上析出的固体的质量:①>②>③>④ |
已知:Cu +2Fe3+ = Cu2+ + 2Fe2+ ,Fe + Cu2+ = Fe2+ + Cu.,在硫酸铁溶液中,加入ag铜,完全溶解后,又加入bg铁,充分反应后得到cg残余固体,且b<c,则下列判断正确的是
| A.最后得到的溶液中不含有Fe3+ |
| B.残余固体可能为铁、铜混合物 |
| C.最后得到的溶液中只含Cu2+ |
| D.残余固体一定全部是铜 |
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法正确的是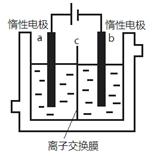
| A.a电极是阴极 |
| B.a极区的KI最终转变为KIO3 |
C.阳极电极反应:4OH--4e-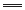 2H2O+O2↑ 2H2O+O2↑ |
| D.电解过程中OH—从a极区通过离子交换膜c进入b极区 |