一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是
| A.t1 min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1 |
| D.10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1 |
下列叙述正确的是
| A.分子晶体中都存在共价键 |
| B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关 |
| C.含有极性键的化合物分子一定不含非极性键 |
| D.只要是离子化合物,其熔点一定比共价化合物的熔点高 |
根据组成特点和所具有的性质,通常把无机物分为单质、氧化物、酸、碱、盐。某物质溶于水,所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,此物质有可能是①单质②氧化物③酸④碱⑤盐
| A.①②④ | B.①②③⑤ | C.②③④ | D.①②③④⑤ |
下列说法不正确的是
| A.利用丁达尔现象可以鉴别胶体和溶液 |
| B.在豆浆里加入盐卤做豆腐与胶体的聚沉有关 |
| C.胶体与溶液的分离可用渗析的方法 |
| D.KCl溶液、淀粉溶液和纯水都属于分散系 |
实验室采购了部分化学药品。右图是从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是
| A.该硫酸的物质的量浓度为9.2mol·L-1 |
| B.1molAl与足量的该硫酸反应产生3g氢气 |
| C.这种硫酸在常温下不能使铁钝化 |
| D.配制200mL2.3mol·L-1的稀硫酸需量取该硫酸25 mL |
老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶
液换成含有少量KSCN的FeCl2溶液,溶液显红色。则该条件下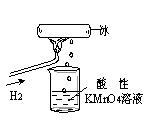
| A.生成的水分子化学性质比较活泼 |
| B.H2燃烧生成了具有氧化性的物质 |
| C.H2燃烧的产物中可能含有一定量的H2O2 |
| D.H2被冷却为液态氢,液氢的水溶液具有还原性 |