(11分)现有反应:
A.CaCO3 CaO+CO2↑ CaO+CO2↑ |
| B.Zn+H2SO4=ZnSO4+H2↑ |
C.C+CO2 2CO 2CO |
| D.2KOH+H2SO4=K2SO4+2H2O |
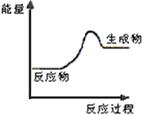
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合下图的是 (填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是 (填反应序号),根据该原电池回答下列问题:
①负极材料是 ,负极发生 (填“氧化”或“还原”)反应;正极反应式为 。
②当导线中有1 mol电子通过时,理论上发生的变化是 (填序号)。 (相对原子质量:H1,Zn65)
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如下图所示。
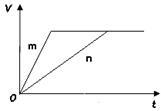
①m曲线表示锌与稀硫酸 (填“X”或“Y”)反应。
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是 (填序号)。
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42-)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s) +O2(g) =2CO(g)△H=。
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<O
CH3OH(g)+H2O(g)△H<O
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如下图所示: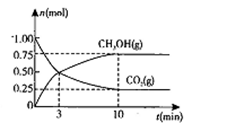
①从反应开始到平衡,H2O的平均反应速率v(H2O)=。
②下列措施中能使化学平衡向正反应方向移动的是(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 |
H2CO3 |
NH3.H2O |
| 电离平衡常数( 25℃) |
Ka1 = 4.30 × 10一7 Ka2= 5.61× 10一11 |
Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知: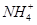 水解的平衡常数Kh=Kw/Kb,
水解的平衡常数Kh=Kw/Kb,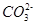
第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈(填“酸”、“中”、 “碱”)性,写出该溶液中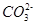 发生第一步水解的离子方程式。
发生第一步水解的离子方程式。
②下列粒子之间的关系式,其中正确的是。
A.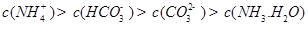
B.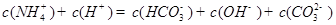
C.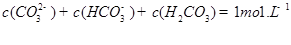
D.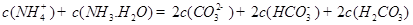
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电材料以CO和O2为原料做成电池。原理如图所示: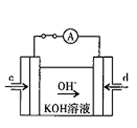
通入CO的管口是(填“c”或“d”),写出该电极的电极反应式:。
(共14分)某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿
(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下: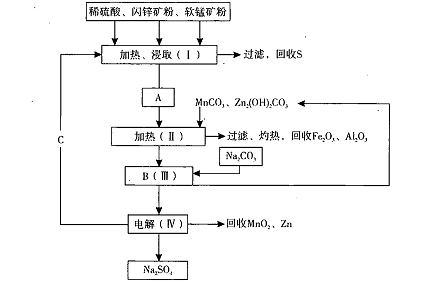
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是。
(2)加入MnCO3、Zn2(OH)2CO3的作用是:C的化学式是。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是。
I.莽草酸的结构简式如图24。请回答:
(1)写出莽草酸的分子式,其中含有的官能团名称为。
(2)该有机物分子1mol最多能和mol NaOH发生反应。
II.图25是以莽草酸A为原料的有机合成路线。

已知D的碳环上一氯代物只有两种。请继续回答下列问题:
(3)C有三种同分异构体,写出其中一种的结构简式。
(4)莽草酸A→D的反应类型是___。
(5)比莽草酸的碳原子数多一个且为苯的同系物的有机物有种。
(6)写出下列反应的化学方程式:。
①D与足量的NaHCO3溶液反应:。
②D→E(需注明18O):。
图23是C60、硅、干冰和砷化镓的晶体结构或分子模型。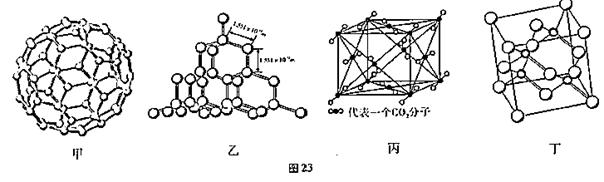
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:。
(2)从晶体类型来看,C60(如图甲)属于晶体。
(3)二氧化硅结构跟晶体硅(如图乙)的结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙晶体硅的结构,结合题中所给二氧化硅的结构信息,分析晶体二氧化硅中硅原子与共价键的个数比为。
(4)图丙是干冰的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷和丙烯分子中2号碳原子的杂化方式分别是和。
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,图丁的砷化镓晶胞。试回答下列问题:
①下列说法正确的是(填序号)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As<Ga
C.电负性:As<Ga D.砷和镓都属于p区元素
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为。
为了探究原电池和电解池的工作原理,某研究性学习小组分别用图所示的装置进行实验。据图回答问题。
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是(填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42—(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸银(FeO2-4)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH(填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH—4e-===2H2O+O2↑和。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn==Fe2O3+ZnO+2K2ZnO,该电池正极发生的电极反应式为。